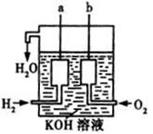
22.(10分)(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
30 |
120 |
280 |
350 |
370 |
①反应速率最大的时间段(即0-1、l-2、2-3、3-4、4-5 min)为_____________,
原因是__________________________________________________
②反应速率最小的时间段为_________,原因是___________________________
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是__________________(填相应字母);
做法中不可行的理由是___________________________________________________。
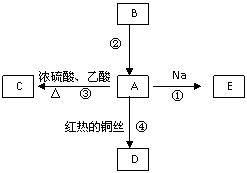
|
(1)写出B的结构简式 ;
(2)写出下列反应的化学方程式
反应①:
反应④:
(3)实验室利用反应③制取C,常用右图装置:
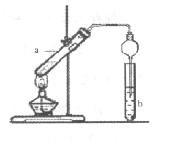 ①a试管中的主要化学反应的化学方程式为
①a试管中的主要化学反应的化学方程式为
|

|
③试管b中观察到的现象是 。
20.(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
|
a |
|
|
|||||
|
|
|
|
b |
c |
d |
|
|
|
e |
|
f |
|
|
g |
|
|
(1) f元素在周期表中的位置是第 周期第 族。
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_____________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为 ,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
 键和一个
键和一个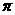 键
键 ΔH=-572kJ/mol 。
请回答下列问题:
ΔH=-572kJ/mol 。
请回答下列问题: