三氟化氮是一种无色、无味、无毒且不可燃的气体,但具有温室效应。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到
(1)写出制备NF3的反应方程式: 。
(2)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 。
(3)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ,其中心原子的杂化方式为 ,该分子属于 分子(填“极性”或“非极性”)。
(1)4NH3+3F2=NF3+3NH4F(2分)
(2)1s22s22p63s23p63d54s1(或[Ar] 3d54s1)(2分)(3)① R (1分) U(1分)
② P (2分) 平面正三角形(2分) sp2 非极性(2分)
图表法、图象法是常用的科学研究方法
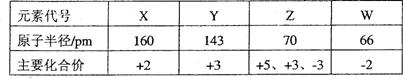
I.短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第
 族。
族。
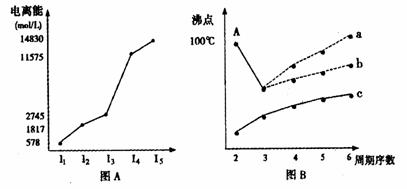
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: ,理由是:
。
CH4、NH3、H2O、HF四种氢化物的沸点从高到低的顺序: > > > 。
 III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的外围电子排布式为 。
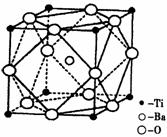
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,是很好的压电材料。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 ;每个氧离子周围的钛离子的配位数为 ,每个钡离子周围的氧离子配位数位为 。
[答案]I.IIIA
II.IVA;b;a点所示的氢化物是水,其沸点高是由于在水分子间存在数目较多、结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水。
H2O>HF>NH3>CH4
III.(1)3d24s2。(2)①BaTiO3;2 ,12
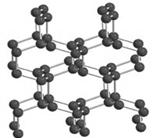
氮是地球上极为丰富的元素。2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,晶体片段结构如右图所示。每个氮原子都通过3个单键与其它氮原子结合并向空间发展构成立体网状结构。这种高聚氮的N-N键的键能为160kJ/mol,而N2的键能为942kJ/mol。
⑴请根据以上信息写出固态高聚氮爆炸成氮气的热化学方程式: 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的
键比
键稳定(填“ ”“
”“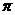 ”)。
”)。
⑶Li3N晶体中氮以N3-存在,基态N3-的电子排布式为

⑷2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
(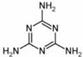 )。
)。
下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
⑸继C60后,科学家又合成了N60、Si60、KnC60等,C、Si、N、K原子电负性由大到小的顺序是 > > > 。
⑴2N(s)=N2(g) △H= -462kJ/mol
(2)

⑶1s22s22p6
⑷B
⑸N>C>Si >K
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为 。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒
① 写出亚铁离子的基态电子排布式 。
② CO有多种等电子体,其中常见的两种为
。CO结构中σ键和П键数目之比为

③Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型),Fe元素的化合价 。
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+周围的阴离子配位数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO:3401kJ/mol、NaCl:786kJ/mol。CaO晶体的熔点 NaCl晶体的熔点(填“高于”、“等于”或“低于”),导致两者晶格能差异的主要原因是
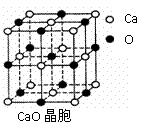 。
。
⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: 。
答案..(12分:每空2分)
A.⑴ N>O>S
⑵ ① 1s22s22p63s23d6 ② N2、CN- 1:2 ③分子晶体 0
⑶ 6 高于 CaO晶体中离子的电荷数大于NaCl
⑷ 甲醇分子间存在氢键,而甲醛没有
如图所示,利用海洋可提取很多重要的化工原料
A、B、C、D、E、F、G都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族,D、G同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
⑴ 写出A、C、E三种元素的符号:
A , C , E 。
⑵ 甲、乙两分子中含有非极性共价键的是 (填分子式)。
⑶ C、D、F的离子中,半径最小的是 (填离子符号)。.
⑷ 在气态单分子化合物FG3中元素F的杂化方式为: 杂化,FG3的空间构型为 。
⑴ H O Na
⑵H2O2
⑶Al3+
⑷sp2 平面三角形
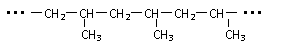 某高聚物的片断结构为
,合成该高分子化合物的单体是
某高聚物的片断结构为
,合成该高分子化合物的单体是
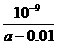 mol·L-1
mol·L-1