17.工业合成氨与制备硝酸一般可连续生产,流程如下:
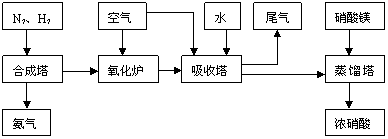
(1)工业生产时,制取氢气的一个反应为:CO+H2O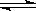 CO2+H2
CO2+H2
① t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K= 。
② 保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)= 。
(2)合成塔中发生反应为:N2(g)+3H2(g)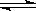 2NH3(g);△H<0。
2NH3(g);△H<0。
|
T/K |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
 右表为不同温度下该反应的平衡常数。由此可推知,表中T1
573K(填“>”、“<”或“=”)。
右表为不同温度下该反应的平衡常数。由此可推知,表中T1
573K(填“>”、“<”或“=”)。
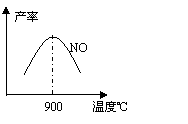
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2 4NO+6H2O;△H=-905 kJ·mol-1
4NO+6H2O;△H=-905 kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时, NO产率下降的原因
。
(4)吸收塔中反应为:3NO2+H2O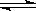 2HNO3+NO。从生产流程看,吸收塔中
2HNO3+NO。从生产流程看,吸收塔中
需要补充空气,其原因是 。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为: CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);△H=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
16. 下图是用0.10
mol/L的盐酸滴定某未知浓度
下图是用0.10
mol/L的盐酸滴定某未知浓度
的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
⑴ 仪器A的名称是 ;
⑵ 盐酸的体积读数:
滴定前读数为 mL,
滴定后读数为 mL 。
⑶ 某实验小组同学的三次实验的实验数据如下表所
示。 根据表中数据计算出的待测NaOH溶液的平均
浓度是
|
实验 编号 |
待测NaOH溶液的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
|
1 |
20.00 |
1.20 |
23.22 |
|
2 |
20.00 |
2.21 |
24.21 |
|
3 |
20.00 |
1.50 |
23.48 |
⑷ 滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)____ ____
⑸ 判断到达滴定终点的实验现象是_________ ____ 。
⑹ 对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 如果上述B步骤省略,对测定结果的影响是 。
②若标准液滴定前滴定管尖端有气泡,滴定后气泡消失。_________
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是 ;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是 ;
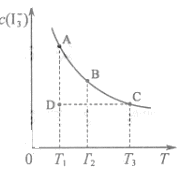 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)
I3-(aq) 2C(g) △H<0,下列各图正确的是:
2C(g) △H<0,下列各图正确的是: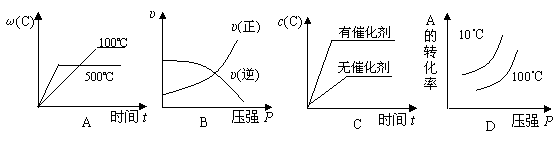
 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比为起始物质,平衡后A的体积分数大于a %的是:
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比为起始物质,平衡后A的体积分数大于a %的是: