21(每空2分,共12分)用NaCl做原料可以得到多种产品。
(1) 工业上由NaCl制备金属钠的化学方程式是
__________________________________________________。
(2) 实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液。
写出电极反应方程式: 阳极_____________________________________________;
若阴阳两极均得到112 mL气体(标准状况),则所得溶液的浓度_____________mol/l(忽略反应前后溶液的体积变化)。
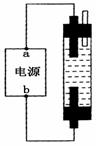 (3) 某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl2被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是_________
(3) 某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl2被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是_________
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
(4) Fe(OH)2固体容易被氧化而不易制取且难以长期保存。某同学用上图装置,只更换了一个电极,通过电解法制取Fe(OH)2。通电后,溶液中产生Fe(OH)2白色沉淀,且较长时间不变色。
该同学换上的电极材料是_________(用元素符号表示)
该电池总的化学反应方程式:__________________________________
22(每空2分,共20分)
(1)已知2NO2(g) N2O4(g); ΔH=-52.7kJ·mol-1,某课外活动小组为了探究温度对化学平衡的影响,做了如下实验:该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
N2O4(g); ΔH=-52.7kJ·mol-1,某课外活动小组为了探究温度对化学平衡的影响,做了如下实验:该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
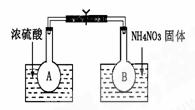 请回答:
请回答:
①B中的混合气体颜色变
(填“深”、“浅”、“不变”)
②由此可知,降低温度,该化学平衡向 _____
(填“正”或“逆”)反应方向移动;
(2)现有可逆反应A(气)+B(气)  3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
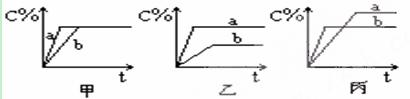
①若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则___ 曲线是表示有催化剂时的情况。
②若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_____ 热反应。
③若丙图中两条曲线分别表示不同压强下的情况,则 _____曲线是表示压强较大的情况。
|
t/℃ |
200 |
300 |
400 |
|
K |
K1 |
K2 |
0.5 |
(3) 在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应
N2(g)+3H2(g)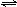 2NH3(g)
⊿H<0,其化学平衡常数K与温度t的关系如表:
2NH3(g)
⊿H<0,其化学平衡常数K与温度t的关系如表:
① 试比较:K1 ____K2(“>”、“=”或“<”)
② 400℃时,反应2NH3(g)  N2(g)+3H2(g)的化学平衡常数的值为
N2(g)+3H2(g)的化学平衡常数的值为
 (4)硫酸生产中,SO2催化氧化成SO3:
(4)硫酸生产中,SO2催化氧化成SO3:
2SO2(g)+O2(g) 2SO3(g); △H<0
2SO3(g); △H<0
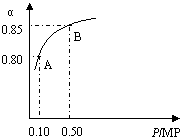
某温度下,SO2的平衡转化率(α)与体系总压强
(P)的关系如右图所示。根据图示回答下列问题:
① 将2.0mol SO2和1.0mol O2置于10L密闭容器中,
反应达平衡后,体系总压强为0.10 MPa。该反应
的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
③物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡是_____(填序号)
A.体系内压强不再改变 B.容器内气体的密度不再改变
C.混合气体的平均分子量不再改变 D . n(SO2) :n(O2):n(SO3)=2:1:2
23(每空2分,共4分)
(1)下列各组热化学方程式中的△H前者大于后者的是 ________
① C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO(g) △H2
② S(g)+O2(g)=SO2(g) △H3 S(s)+O2(g)=SO2(g) △H4
③ H2(g)+1/2O2(g)=H2O(g) △H5 2H2(g)+O2(g)=2H2O(g) △H6
④ CaCO3(s)=CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)=Ca(OH)2(s) △H8

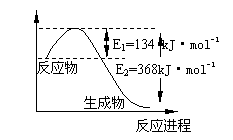 (2)右图是1 mol NO2和1 mol CO反应生成CO2
(2)右图是1 mol NO2和1 mol CO反应生成CO2
和NO过程中能量变化示意图,请写出NO2和 CO[来
反应的热化学方程式
24(每空2分,共10分)
(1)恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)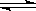 C(气)
C(气)
①若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 ________mol。
②若开始时放入3molA和3molB,到达平衡后,生成C物质的量为 mol。
③若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
(2).若维持温度不变,在一个与①反应前起始体积相同、且容积固定的容器中发生上述反应。
开始时放入1molA和1molB到达平衡后生成b molC。将b与①小题中的a进行比较(选填一个编号) 。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
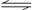 2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( ) 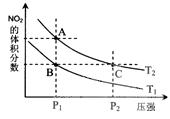 A.A、C两点的反应速率:A>C
A.A、C两点的反应速率:A>C NO2+SO2
NO2+SO2 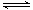 Z(g)+W(s);△H>0 下列叙述正确的是( )
Z(g)+W(s);△H>0 下列叙述正确的是( ) 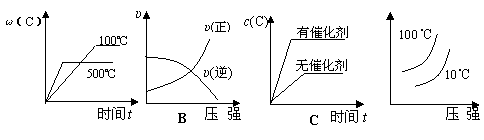
 xC(g)+2D(g),当反应达到平衡时,生成0.4 mol
D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol
D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )