16.⑴(8分)
|
加入物质 变量 |
H2O |
NH4Cl(s) |
NaOH(s) |
浓盐酸 |
|
⑴c(NH3·H2O) |
|
|
|
|
|
⑵n(OH-) |
|
|
|
|
|
⑶c(OH-) |
|
|
|
|
|
⑷电离平衡移动方向 |
|
|
|
|
⑵(2分)
⑶(5分).某温度下,纯水中的c(H+)=1×10-6mol/L,则此溶液中
c(OH-)为 mol/L,溶液的pH为 ;若温度不变时,滴入盐酸,使
c(H+)=1×10-4 mol/L,则溶液中c(OH-)为 mol/L,溶液的pH为 ;若将此盐酸溶液稀释1000倍,则溶液的pH约为 。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共72分)
15.⑴(2分)①
②
⑵(8分)①下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是________
②则起始读数为_________ mL,终点读数_______ ____mL;
③c(NaOH)= 。
16.⑴(8分)NH3·H2O的电离方程式为NH3·H2O≒NH4++OH-。若在氨水中加入下表中的物质,氨的电离平衡及平衡时物质的浓度有何变化?请填写下表。
|
加入物质 变量 |
H2O |
NH4Cl(s) |
NaOH(s) |
浓盐酸 |
|
⑴c(NH3·H2O) |
|
|
|
|
|
⑵n(OH-) |
|
|
|
|
|
⑶c(OH-) |
|
|
|
|
|
⑷电离平衡移动方向 |
|
|
|
|
⑵.(2分)在25℃时,若10体积某强酸溶液与1体积某强碱溶液混合后,溶液呈中性,则混合之前该酸的pH与强碱的pH之间应满足的关系是 。
⑶.(5分)某温度下,纯水中的c(H+)=1×10-6mol/L,则此溶液中
c(OH-)为 mol/L,溶液的pH为 ;若温度不变时,滴入盐酸,使
c(H+)=1×10-4 mol/L,则溶液中c(OH-)为 mol/L,溶液的pH为 ;若将此盐酸溶液稀释1000倍,则溶液的pH约为 。
15.⑴(2分)下面所列的是中学化学实验中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯。
①若要进行中和滴定实验,还缺少的玻璃仪器是________________________。
②若要用碳酸钠固体配制一定物质的量浓度的溶液,还缺少的玻璃仪器是 。
⑵(8分)某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
①下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B. 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗
 净后没有干燥
开始 结束
净后没有干燥
开始 结束
C. 酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
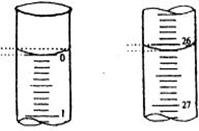
②若滴定开始和结束时,酸式滴定管中的液
面如图所示:则起始读数为_________mL,终点
读数_____________mL;
③某学生根据三次实验分别记录有关数据如下:
|
滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
 东海县第二中学高二年级化学学科学情调查答案卷
东海县第二中学高二年级化学学科学情调查答案卷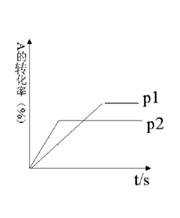 现有可逆反应:aA(g)+ bB(g)
现有可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据下列图示回答:
cC(g)+ dD(g);根据下列图示回答: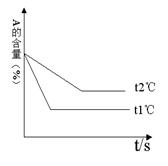
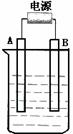 19.(8分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重 1.6 g。请回答下列问题
19.(8分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重 1.6 g。请回答下列问题