21(4分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的反应(由氨气、HCl和水制备NH4C1水溶液),推断反应④的反应热为________ kJ/mol。
① NH3(g)+HCl(g)=NH4Cl(s) △H=-176kJ/mol
② NH3(g) = NH3(aq) △H=-35.1kJ/mol
③ HCl(g) = HCl(aq) △H=-72.3kJ/mol
④ NH4C1(s) = NH4C1(aq)
⑤ NH3(aq)+HCl(aq)=NH4C1(aq) △H=-52.3kJ/mol
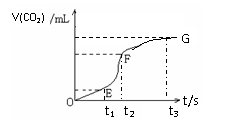
22(9分)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快,_______时刻收集的二氧化碳气体最多。(用t表示的时间填写)
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
 A.蒸馏水
A.蒸馏水
B.少量氯化钠固体
C.氯化钠溶液
D.浓盐酸
E.少量CH3COONa固体
23(7分)将等物质的量的A、B混合于容积为2L的密闭容器中,发生如下反应:
 3A(g)+B(g)
3A(g)+B(g)  xC(g)+2D(g)经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L·min)。
xC(g)+2D(g)经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L·min)。
试求: (1)此时A的浓度及反应开始前容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值。
24(10分)已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气燃烧的热化学方程式 。
(2) molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为 890 kJ( 填“>”、 “<”、“= ”)。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量Q的取值范围是 。
(4)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量Q的的取值范围是: 。
25(10分)在密闭容器中,将1.0mol
A与1.0mol
B混合加热到800℃,发生下列反应:A(g)+B(g) C(g)+D(g)一段时间后该反应达到平衡,测得A的物质的量为0.5mol。回答下列问题:
C(g)+D(g)一段时间后该反应达到平衡,测得A的物质的量为0.5mol。回答下列问题:
(1)平衡时A的转化率为 ,该反应的化学平衡常数为 。
(2)如果保持温度不变继续向该平衡体系中通入1.0mol的B(g),相同条件下反应达到新的平衡状态,则A的转化率将 (填“增大”、“减小”、“不变”),A的转化率为 。
(3)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果判断该反应的△H 0(填“>”、“=”或“<”)。
哈 师 大 附 中 高 二 学 年 月 考 2009、10
化 学 试 卷 答 题 纸
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
21(4分)_______ kJ/mol。
22(9分)(1) (2)
23(7分)(1) 此时A的浓度及反应开始前容器中A、B的物质的量。
(2) B的平均反应速率。
(3) x的值。
24(10分) (1) 。
(2) 890 kJ( 填“>”、 “<”、“= ”)。
(3) 。
(4) 。
25(10分)(1)
(2) (填“增大”、“减小”、“不变”)
(3)
哈 师 大 附 中 高 二 学 年 月 考 2009、10
化 学 试 卷 答 题 纸
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
C |
B |
A |
B |
B |
A |
B |
C |
D |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
D |
D |
C |
C |
AB |
BC |
CD |
CD |
BC |
AB |
21(4分)+16.3 kJ/mol。
22(9分)(1) t1~t2 t3 (2)ACE
23(7分)3mol 0.75mol/L
0.05mol/(L.min)
2
24(10分) (1)H2(g) +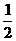 O2(g) = H2O(l) △H=-286 kJ/mol
O2(g) = H2O(l) △H=-286 kJ/mol
(2)<
(3)283akJ < Q <890akJ
(4)284.5akJ < Q <586.5akJ
25(10分)(1)50%, 1
(2)增大 66.7%
(3)<
 2NH3(g)
的下列叙述中,能说明反应已达到平衡的是( )
2NH3(g)
的下列叙述中,能说明反应已达到平衡的是( )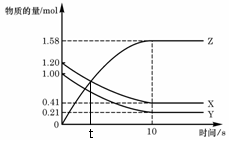 一定温度下,在2
L的密闭容器中,X、Y、Z
一定温度下,在2
L的密闭容器中,X、Y、Z