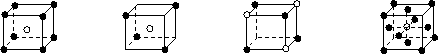28. 下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
 ④ ④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1) 以上10种元素的原子中,失去核外第一个电子所需能量最少的是 __(填写编号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)_______________________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________ ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式____________________________________。
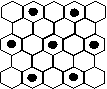
(3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 ___ 。
27、1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
(1) 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:
_________<X<_________。
(2) 根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
____________________________________________________________________;简述元素电负性X的大小与元素金属性、非金属性之间的关系____________________________________________________________________。
(3) 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是
_____________________________________________________________________
 _____________________________________________________________.
_____________________________________________________________.
24. 随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容仪器A中
 ②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用 (填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是否用酸式滴定管还是用碱式滴定 管 ,理由是
|
(3)能否用水代替苯 ,理由是
。
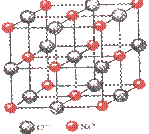
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为 。

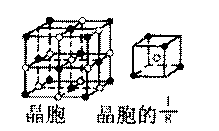
 (3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“ ”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心。该化合物的电子式是
。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“ ”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心。该化合物的电子式是
。