0 28598 28606 28612 28616 28622 28624 28628 28634 28636 28642 28648 28652 28654 28658 28664 28666 28672 28676 28678 28682 28684 28688 28690 28692 28693 28694 28696 28697 28698 28700 28702 28706 28708 28712 28714 28718 28724 28726 28732 28736 28738 28742 28748 28754 28756 28762 28766 28768 28774 28778 28784 28792 447348
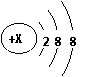
 25(10分)
25(10分) (2) 根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的
族。
(2) 根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的
族。
 (6)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:
(6)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:
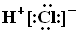 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF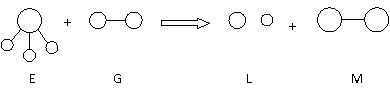




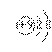 A.F-的结构示意图: B.CO2的分子模型示意图:
A.F-的结构示意图: B.CO2的分子模型示意图:
 D.N2的结构式:
:N≡N:
D.N2的结构式:
:N≡N: