18.下图是元素周期表的一部分
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
|
|
|
⑥ |
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
⑨ |
|
|
|
⑩ |
|
|
|
|
|
|
|
|
|
|
(1)写出元素⑩的基态原子的电子排布式_______________,指出它在周期表中的位置_______________。焊接钢轨时,常利用⑩的某些氧化物与⑦的单质在高温下发生反应,试写出其中一种反应的化学方程式__ ____ 。
(2)①③⑤三种元素可以形成多种有机化合物分子,其中一种是室内装潢时形成的主要气体污染物。试写出它的电子式_________________,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为__ ___。
(3)③④⑤⑥⑧五种元素都可以与元素①形成化合物,其中熔点最高的是_________(写化合物的化学式)。如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是 。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
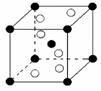 (5)元素⑨的主要矿物有钛铁矿(主要成分FeTiO3)和金红石,金红石
(5)元素⑨的主要矿物有钛铁矿(主要成分FeTiO3)和金红石,金红石
的主要成分的晶胞结构如右图所示:(以钛为中心原子,6个氧在其
周围形成八面体结构,斜放在晶胞中)金红石的主要成分钛的氧
化物化学式可表示为 。
17.在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g) ΔH=QkJ·mol-1,
CO(g)+H2O(g) ΔH=QkJ·mol-1,
其化学平衡常数K和温度t的关系如下:
|
t/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.25 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”);
(2)能判断该反应已达到化学平衡状态的依据是 ;
a.容器中压强不变 b.ΔH不变
c.v正(H2)=v逆(CO) d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时各物质的物质的量浓度(mol·L-1)的变化
|
时间/min |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
C1 |
C2 |
C3 |
C3 |
|
4 |
C1 |
C2 |
C3 |
C3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:3min时c(CO))= mol·L-1 , H2O(g)的转化率= ;
②反应在4min-5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min-6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气
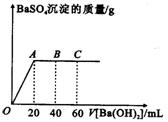 在25℃时向20mL稀硫酸和盐酸的混合溶液中,逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的质量如图所示,当加入60mLBa(OH)2溶液时,C点溶液的pH=7,试回答:
在25℃时向20mL稀硫酸和盐酸的混合溶液中,逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的质量如图所示,当加入60mLBa(OH)2溶液时,C点溶液的pH=7,试回答: 2C(s)+2H2(g)+O2(g) CH3COOH(l)
2C(s)+2H2(g)+O2(g) CH3COOH(l) (2)反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变为
。
(2)反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变为
。 一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始
一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始 
 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.30mol/L。下列判断中正确的是
( )
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.30mol/L。下列判断中正确的是
( )