17. 反应2X(g)+Y(g) 2Z(g)(正反应为放热反应),在不同温度(T1和T2)及不同压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图中a、b、c三曲线所示。下述判断中正确的是 ( )
反应2X(g)+Y(g) 2Z(g)(正反应为放热反应),在不同温度(T1和T2)及不同压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图中a、b、c三曲线所示。下述判断中正确的是 ( )
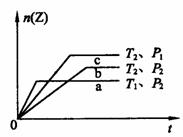 . A.T1>T2;P1<P2 B.T1<T2;P1>P2
. A.T1>T2;P1<P2 B.T1<T2;P1>P2
C.T1>T2;P1>P2 D.T1<T2;P1<P2
|
电池的作用,将化学能转变为电能;而充电时起电解池的作
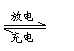 用,将电能转变为化学能贮存起来。某蓄电池充电和放电时
用,将电能转变为化学能贮存起来。某蓄电池充电和放电时
发生的反应为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2。关于此蓄电池有下列说法:
①放电时,NiO2为正极;②充电时,阳极反应式为:Fe(OH)2+2e-= Fe+2OH-;
③放电时,电解质溶液中的阳离子向正极方向移动;
④充电时,Ni(OH)2的反应式为:Ni(OH)2-2e-= NiO2+2H+;
⑤蓄电池的电极必须浸在碱性电解质溶液中;
其中正确的组合是 ( )
A.②③④ B.①②③ C.②④⑤ D.①③⑤
|
. 19.(8分)在某温度下,A+B 2C类型的反应达到平衡:
19.(8分)在某温度下,A+B 2C类型的反应达到平衡:
(1)若升高温度时,C的浓度减小,则正反应是 热反应,在升高温度时,正反应速率 (填“增大”、“减小”或“不变”,下同),逆反应速率 。
(2)在增加或减少B物质时,平衡不移动,则B物质为 态。
(3)若A为气态物质,增大压强平衡不移动,则B的物质为 态,C为 态。
(4)若加入正催化剂,平衡 移动,达到平衡状态的时间 (填“延长”、“缩短”或“不变”)。
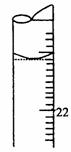 20.(10分)某学生用0.1000 mol·L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
20.(10分)某学生用0.1000 mol·L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴
酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使
之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
|
回答下列问题:
(1)正确的操作顺序是:B、 、F(填序号)
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是 ;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为 mL。
9.下列措施一定能使反应速率加快的是 ( )
①增加反应物的物质的量 ②升高温度 ③缩小反应容器体积 ④加入生成物
⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
|
A.Fe-2e-= Fe2+ B.2H2O+O2+4e-= 4OH-
C.2H++2e-= H2↑ D.4OH--4e-=2H2O+O2↑
 +H2O
+H2O