18. (10分) A、B、C、D、E、F六种短周期元素,它们的核电荷数依次增大。A、B不在同一周期;A与E、B与F分别同主族;A、B、E、F四种元素原子最外层电子数之和为10;D能与A、B、C、E、F元素分别形成原子个数比为1∶1或2∶1型化合物。
(10分) A、B、C、D、E、F六种短周期元素,它们的核电荷数依次增大。A、B不在同一周期;A与E、B与F分别同主族;A、B、E、F四种元素原子最外层电子数之和为10;D能与A、B、C、E、F元素分别形成原子个数比为1∶1或2∶1型化合物。
(1) D分别与A、B、C、E、F元素形成的化合物中,属于原子晶体的是 ▲ (用化学式表示)。
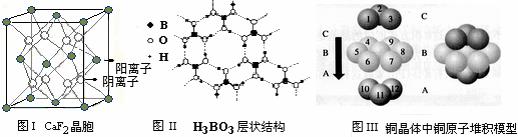
(2) 右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 ▲ 。E与D按原子个数比1∶1形成的化合物的电子式为 ▲ 。
(3) 下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C-D |
D-D |
|
键能(KJ· mol-1) |
460 |
176 |
347.7 |
347 |
745 |
479.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序: ▲ (用abc表示)。
a.F与B形成的化合物 b.A与B形成的化合物 c.E的单质
②试估算1molF单质晶体完全燃烧的反应热:ΔH= ▲ 。
16.(14分) 纯净的过氧化钙(CaO2)是白色的结晶粉末,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。
为测定样品中CaO2的含量(样品中不含其它氧化性杂质),某化学兴趣小组同学设计了如下实验步骤:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的bg KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应;
第二步,用反应后溶液准确配制100 mL溶液;
第三步,准确量取25 mL上述溶液于锥形瓶中,并向其中加入几滴淀粉溶液;
第四步,滴入浓度为c mol/L的Na2S2O3溶液至反应完全(反应原理:I2+2S2O32-==2I-+S4O62-);
第四步,记录数据并计算。
(1)写出第一步实验中反应的化学方程式: ▲ 。
(2)配制100 mL上述溶液所需的主要玻璃仪器是 ▲ 。Na2S2O3属强碱弱酸盐,用 ▲ (填“酸式”或“碱式”)滴定管装Na2S2O3溶液,向洁净滴定管中加入Na2S2O3溶液前的两步操作方法是 ▲ 。
(3)滴定操作时,一般左手控制 ▲ ,右手握持锥形瓶,边滴边振荡,眼睛注视 ▲ ,判断滴定达到终点的现象为 ▲ 。
(4)下表是该实验的记录结果:
|
滴定次数 |
待测溶液的体积 |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.05 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.12 |
20.09 |
根据上述实验数据,CaO2的质量分数表达式为 ▲ (不必化简)。
(5)滴定前,滴定管的尖嘴部分有气泡,滴定后,滴定管的尖嘴部分气泡消失,对测定CaO2的质量分数结果的影响是 ▲ (填“偏大”、“偏小”或“不变”,下同);滴定过程中,若向锥形瓶中滴加Na2S2O3溶液速率过慢,则测得的CaO2的质量分数结果可能 ▲ ,后者的原因是 ▲ 。
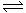 2NH3(g);△H=-92.4kJ/mol。
2NH3(g);△H=-92.4kJ/mol。 (5) 随着合成氨研究的发展,希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),吸附在SCY内外表面上的金属钯多晶薄膜作为两个电极实现了常压、570℃条件下高转化率的电化学合成氨。其实验装置如上图。
(5) 随着合成氨研究的发展,希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),吸附在SCY内外表面上的金属钯多晶薄膜作为两个电极实现了常压、570℃条件下高转化率的电化学合成氨。其实验装置如上图。 H+
+ B2–
H+
+ B2–