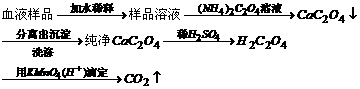
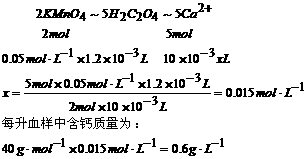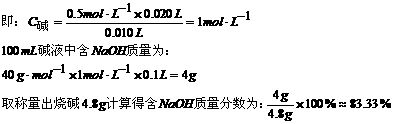规律一:恒温恒容条件下,对于反应前后气体分子数改变的反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”),与原平衡相等,则两平衡等效。
2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 0 0 2mol
途径3起始 1mol 0.5mol 1mol
途径4起始 0.5mol ? ?
途径5起始 amol bmol cmol
[问题]: ①途径2、 3与1等效吗?
②途径4 中O2(g) 和 SO3(g)的起始量为多少, 平衡时可与途径1平衡时SO3(g)的含量相同?
③途径5中a、b符合怎样的关系达到的平衡状态与1相同?
[例2]恒温恒容时,判断哪些是等效平衡? ( A B D )
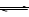 N2 + 3H2 2NH3
N2 + 3H2 2NH3
A.2mol 6mol 0mol
B. 0mol 0mol 4mol
C. 0.5mol 1.5mol 1mol
D. 1mol 3mol 2mol
[例3].将2molSO2(g)和2molSO3(g)混合于某固定体积的容器中,在一定条件下达平衡。平衡时SO3(g)为wmol,同温下,分别按下列配比在相同体积的容器中反应,达平衡时SO3(g)的物质的量仍为wmol的是( )
A 2molSO2(g)+1mol O2(g)
B 4mol SO2(g)+ 1mol O2(g)
C 2mol SO2(g)+ 1mol O2(g)+ 2mol SO3(g)
D 3mol SO2(g)+1.5mol O2(g)+ 1mol SO3(g)
[例4]在一个固定容积的密闭容器中加入2molA和1molB,发生反应2A(g)+B(g)≒3C(g)+D(g),达到平衡时,C的浓度为wmol/L。若维持容器的容积和温度不变,按下列情况配比为开始浓度,达到平衡后C的浓度仍为wmol/L的是( )
A、4molA+2molB
B、2molA+1molB+3molC+1molD
C、3molC+1molD+1molB
D、3molC+1molD
E、1molA+0.5molB+1.5molC+0.5molD
规律二:在恒温恒容条件下,对于反应前后气体分子数不变的可逆反应,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”),与原平衡相等只要反应物(或生成物)的物质的量的比例与原平衡相同,两平衡等效。
[例1] 在定温定容条件下,发生如下反应
H2(g)+I2(g)
 2HI(g)
2HI(g)
途径1 1 mol 1mol 0
途径2 0mol 0 2mol
途径3 2mol 2mol 0
途径4 0mol 0mol 4mol
上述途径与1是否等效?
[讲述]:途径3可认为是同温同容时两个途径1,每个都与1等效然后加压平衡不移动,所以与1等效(见图)

|
|
|
|
恒温恒容,发生反应
H2(g)+I2(g)  2HI(g)
2HI(g)
途径1 2 mol 1mol 0
途径2 1mol 0 1mol
途径3 4mol 2mol 0
途径4 3mol 1mol 2mol
上面与途径1等效的有________________
[例2]将装有1molHI的容器密封并加热,部分HI分解成H2和I2(g)并达到化学平衡。此时I2(g)的体积分数为x%,若在该容器中加入2molHI后密封,加热到相同温度使之达到平衡,设此时I2的体积分数为y%,则x与y的关系为( )。
A. 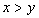 B.
B. 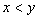 C.
C.  D.
D. 
规律三:在恒温恒压时,此时各不相同的起始状态,也可以把一边“归零”换算成同一半边,只要各物质的物质的量之比相同,则两平衡等效可以把一边“归零”换算成同一半边,只要各物质的物质的量之比相同,则两平衡等效
[例1]如果定温定压条件下,
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 4 mol 2 mol 0
途径1和2是否为等效平衡?
|
|
|
若反应为:H2(g)+
I2(g)  2HI(g)
2HI(g)
途径1 2 mol 1mol 0
途径2 4mol 2mol 0
|
|
|
同步练习
1.可逆反应A(g)+B(g)  2C(g),在固定容积的容器中进行。若向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为n%,若向容器中充入2molA和3mol B,在某温度下达到平衡时,C的体积分数为m%则m和n的正确关系为 ( )
2C(g),在固定容积的容器中进行。若向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为n%,若向容器中充入2molA和3mol B,在某温度下达到平衡时,C的体积分数为m%则m和n的正确关系为 ( )
A . m>n B. m<n C . m=n D. 无法比较