1.对盐类水解程度的理解:
盐类水解反应是中和反应的逆反应,即:
酸+碱 盐+水
盐+水
不论从酸、碱反应开始,还是从盐水解反应开始,一定条件下都能达到平衡。若盐的水解程度对某化学现象的产生起积极作用,则考虑盐的水解;若盐的水解程度对化学现象的产生不起积极作用,则不考虑水解。盐的水解程度主要决定于盐的结构,次要决定于外部条件。
中和反应的趋势(强对强易反应、强对弱能反应,弱对弱慢反应)越大,程度越深,则水解反应的趋势(两强不水解,强弱能水解,两弱易水解)越小,程度越浅。见下表:
某些盐的水解情况
|
名称 |
0.1 mol·L-1溶液 |
|
|
h(水解度) |
pH |
|
|
NH4Cl CH3COONa NaHCO3 Na2CO3 CH3COONH4 |
0.0085% 0.0085% 0.048% 4.2% 0.56% |
5.1 8.8 8 11.6 ≈7 |
由此可见,对一般盐(特别是强酸弱碱盐和强碱弱酸盐)通常情况下水解趋势不大,其逆反应(中和反应)趋势较大。对0.1 mol·L-1 Na2CO3溶液碱性已较强,但水解程度仅有4.2%。对一般弱酸弱碱盐类通常情况下水解程度也较小,如0.1 mol·L-1 CH3COONH4溶液水解度只有0.56%。所以,通常考试的水解只决定溶液的酸碱性和溶液中离子浓度(或排序问题)。
但有部分弱酸弱碱盐水解程度较大,如Al2(CO3)3、Al2S3、(NH4)2S等,由于它们的阴阳离子水解产物是易挥发的气体或沉淀,离开平衡体系而促进水解反应进行完全。如:
2Al3++3S3-+6H2O====2Al(OH)3↓+3H2S↑
因此,Al2(CO3)3、Al2S3几乎百分之百完全水解,不能存在于水溶液中。(NH4)2S溶液的水解度高达99.9%。
 和HCO
和HCO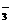 都可以水解,且溶液均为碱性,但AlO
都可以水解,且溶液均为碱性,但AlO
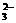 +H2O的发生,因此上述盐溶液的混合是既促进了AlO
+H2O的发生,因此上述盐溶液的混合是既促进了AlO 等的电离;PO
等的电离;PO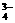 的水解与H2PO
的水解与H2PO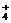 与AlO
与AlO HCO
HCO