网址:http://m.1010jiajiao.com/timu3_id_245832[举报]
A.酶是具有催化作用的蛋白质 B.由题可知酶具有选择性和专一性
C.高温或重金属盐能降低酶的活性 D.酶在强酸、强碱条件下才能发挥作用
查看习题详情和答案>>
 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)△H<0
副反应 2H2O2=2H2O+O2↑
滴定反应 6KMnO4+5(2Na2CO3?3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O
50°C时 2Na2CO3?3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是
(2)步骤①的关键是控制温度,其措施有
(3)在滤液X中加入适量NaCl固体或无水乙醇,均可析出过碳酸钠,原因是
(4)步骤③中选用无水乙醇洗涤产品的目的是
(5)下列物质中,会引起过碳酸钠分解的有
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000g 过碳酸钠于250mL 锥形瓶中,加50mL 蒸馏水溶解,再加50mL 2.0mol?L-1 H2SO4,用2.000×10-2 mol?L-1 KMnO4 标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为
(1)根据你所掌握的化学知识作出如下判断:当事人使用的液态洁污剂之一必定含氯,其中氯最可能的存在形式是______________和________________(填离子),当另一种具有_______________(性质)的液态洁污剂与之混合,可能发生上述反应而产生氯气。举例说明这两种洁污剂的名称(家用洁污剂的商品名称):_________________,_________________。
(2)请你对市场上的洁污剂进行分类调查,将调查结果汇总统计后,结合你所学的知识对各种品牌的洁污剂进行分析,并为消费者指出使用不同类型的洁污剂时应注意的问题。
______________________________________________________________________
查看习题详情和答案>>
(1)下列实验操作或对实验事实的描述不正确的是_________(填序号)。
①用热的浓HCl洗涤附着有MnO2的试管;②浓硫酸不小心沾在皮肤上,先用抹布擦干净,再用大量的水冲洗;③测定硫酸铜晶体中结晶水含量的实验中,至少需经过4次称量;④将乙烯、乙炔分别通入溴水中,乙烯使溴水的褪色速率快;⑤蒸馏石油时,冷凝管中的冷水应上进下出;⑥向蛋白质溶液中加入浓的无机盐(如Na2SO4、CuSO4)溶液,可使蛋白质盐析而分离提纯;⑦在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成;⑧配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(2)实验室利用如下图装置进行中和热的测定。
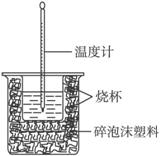
①该图中有两处未画出,它们是______________________、_________________________;
②在操作正确的前提下提高中和热测定的准确性的关键是___________________________;
③如果用0.5 mol·L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热将(填“偏大”“偏小”“不变”);原因是____________________________________________。
查看习题详情和答案>>(9分)A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成.甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体.这些单质和化合物之间存在如下关系:
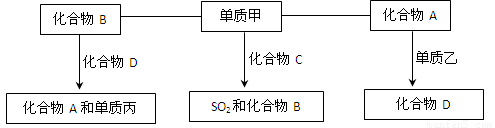
(1)写出下列物质的分子式:A_______ 甲_______、丙_______.
(2)写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式_____________.
(3)标准状况下将28L化合物A与足量的过氧化钠充分反应转移电子的数目为
(4)在密闭容器中,化合物B跟化合物D在高温下生成化合物A和单质丙的反应是可逆反应,其化学方程式为__________。
(5)化合物C的稳定性比化合物B (填强或弱)。
【解析】本题属于无机框图题,关键是寻找突破点。常见的液体是水,则B是水。单质和化合物反应生成SO2和水的反应,根据原子守恒可知甲应是氧气,C是H2S。单质和气态化合物反应生成另外一种气态化合物的,常见的是CO2和C的反应生成CO,因此A是CO2,D是CO,乙是C。CO在高温下和水蒸气反应又生成CO2和氢气,所以丙是氢气。
(1)(2)(4)略
(3)28LCO2的物质的量是 。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
(5)S的非金属性弱于O的,所以H2S的稳定性弱于H2O的。
查看习题详情和答案>>