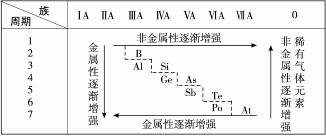
0 23470 23478 23484 23488 23494 23496 23500 23506 23508 23514 23520 23524 23526 23530 23536 23538 23544 23548 23550 23554 23556 23560 23562 23564 23565 23566 23568 23569 23570 23572 23574 23578 23580 23584 23586 23590 23596 23598 23604 23608 23610 23614 23620 23626 23628 23634 23638 23640 23646 23650 23656 23664 447348
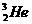 ,原子结构示意图为
,原子结构示意图为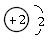 。4He也是He元素中同位素的一种,原子符号
。4He也是He元素中同位素的一种,原子符号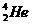 。
。