21.(12分)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比试验。
|
实验编号 |
实验目的 |
T/K |
pH |
c/10-3 mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
3 |
6.0 |
0.30 |
|
③ |
|
298 |
10 |
6.0 |
0.30 |
(1)表中设计②的温度是 ,设计③的实验目的为: 。
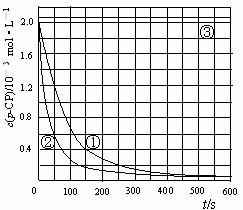 [数据处理]实验测得p-CP的浓度随时间变化的关系如图
[数据处理]实验测得p-CP的浓度随时间变化的关系如图
(2)请根据上图实验①曲线,计算降解反应在50 s-150 s内的反应速率:v (p-CP) = mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 
(4)实验③得出的结论是:pH等于10时, 。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
19.(16分)下表是元素周期表的一部分,完成以下有关问题。
|
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
① |
② |
③ |
④ |
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
⑩ |
(1)在①~⑩元素中,最不活泼的元素是_____(写元素符号,下同);最高价氧化物对应的水化物的酸性最强的元素是 ;非金属性最强的元素的单质与水反应的化学方程式是:

(2)⑤和⑥的最高价氧化物对应的水化物互相反应的离子方程式是 。
(3)写出⑧的离子的结构示意图 ;②、③、④的氢化物中最稳定是 (填化学式)。
(4)①的单质置换出⑦的单质的化学方程式是: 。
(5)①的一种氢化物的产量是衡量一个国家石油化学工业发展水平的标志,该氢化物与⑨的氢化物反应的化学方程式为 ,该反应类型是 。
(6)④⑤⑥元素对应的离子半径从大到小的顺序是 (写出离子符号)。
 2SO3(g)
△H = -QKJ/mol。测得SO2的转化率为90%,则在此条件下,反应放出的热量为
2SO3(g)
△H = -QKJ/mol。测得SO2的转化率为90%,则在此条件下,反应放出的热量为
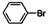 )和溴化氢,该反应是放热反应。¥高#考#资%源*
)和溴化氢,该反应是放热反应。¥高#考#资%源*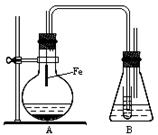 ①检查气密性,然后向烧杯中加入一定量的苯和液溴;
①检查气密性,然后向烧杯中加入一定量的苯和液溴;
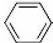 +Br2
+Br2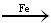
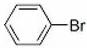 +HBr (2分)
+HBr (2分)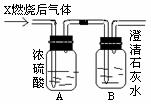 (1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是
。
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是
。 2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·s-1,则10s后容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·s-1,则10s后容器中B的物质的量是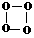 ),有关O4有说法正确的是( )
),有关O4有说法正确的是( )