28、已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,某探究小组用KMnO4酸性溶液与H2C2O4(草酸)溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol· L-1、0.0010 mol· L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol· L-1)的用量均为2 mL。
(1) 请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
催化剂的用量 / g |
酸性KMnO4溶液的浓度/mol·L-1 |
实验目的 |
|
① |
298 |
0.5 |
0.010 |
a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究温度对反应速率的影响; c. 实验①和④探究催化剂对反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
(2)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
|
实验编号 |
溶液褪色所需时间 t / min |
||
|
第1次 |
第2次 |
第3次 |
|
|
① |
14.0 |
13.0 |
11.0 |
|
② |
6.5 |
6.7 |
6.8 |
则实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。ks5*u
24、有机物在反应中,常有下列原子间的共价键全部或部分断裂,如C-H、C-C、C=C、C-O、C═O等。下列各反应中,反应物分子中断裂键的排列,正确的组合是
|
化学反应 |
乙醇酯化 |
乙醇氧化 |
丙烷取代 |
乙酸酯化 |
丙烯加成 |
|
A |
O-H |
C-H |
C-H |
C-O |
C=C |
|
B |
O-H |
O-H |
C-C |
C═O |
C-H |
|
C |
C-O |
C-O |
C-H |
O-H |
C-C |
|
D |
C-O |
C-H |
C-C |
C-O |
C=C |
23、有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
|
第一组 |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
|
第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
第四组 |
H2O 100.0 |
H2S -60.2 |
H2Se -42.0 |
H2Te -1.8 |
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
 2009学年第二学期温州市省一级重点中学期末统一测试
2009学年第二学期温州市省一级重点中学期末统一测试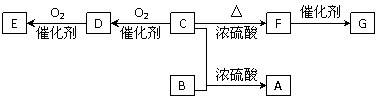
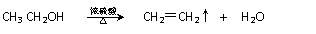 ④又已知醇在浓硫酸、加热条件下能发生以下类似的反应:
④又已知醇在浓硫酸、加热条件下能发生以下类似的反应: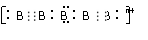 (4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B
(4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B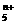 电子式
, 则n值为___ 。ks5*u
电子式
, 则n值为___ 。ks5*u