17.(13分)NO2与Na2O2常温下能反应。反应时何者为氧化剂?两同学开展如下研究。
[作出猜想]甲乙同学对反应如何进行有如下猜想:
猜想一:Na2O2+2NO2=2NaNO2+O2↑
猜想二:2Na2O2+4NO2=4NaNO3
 [查阅资料]2Na2O2+2H2O=4NaOH+O2↑
[查阅资料]2Na2O2+2H2O=4NaOH+O2↑
2NO2+2NaOH=NaNO2+NaNO3+H2O
2NaNO2+2HCl=2NaCl+NO↑+NO2↑+H2O
[实验探究]a.按图示实验装置开展实验。实验时,往装置中通入足量的NO2,直至反应停止;b.取反应后玻璃直管中固体物质于试管中进行如下实验,并观察、记录现象:
|
实验操作 |
实验现象 |
|
|
|
[实验结论]现象表明,Na2O2与NO2反应按“猜想二”进行。
回答下列问题:
(1)实验时,利用铜与浓硝酸制取NO2,反应方程式为________________________。
(2)装置C的作用是____________________________。
(3)根据实验结论,NO2与Na2O2反应时作氧化剂的物质是_______________。
(4)请根据实验目的要求和实验结论,将“实验探究”栏目中的表格填写完整。
(5)甲乙同学都认为,不宜直接观察C装置导管口是否有气泡冒出即可判断Na2O2与NO2反应究竟按哪种猜想进行。其原因是________________________________________。
第Ⅱ卷(综合能力测试,共50分)
14.(9分)为完成实验,有下列可供选择的实验方案:
A.与消石灰共热,并将湿润红色石蕊试纸置于试管口
B.先加入足量的稀硝酸,再滴入适量BaCl2溶液
C.加入足量氢氧化钠溶液直至过量,充分反应后过滤
D.加入足稀硫酸溶液直至过量,充分反应后过滤
E.先加入足量的稀盐酸,再滴入适量BaCl2溶液
根据实验要求,选择合适方案填入I中,并根据所选方案所产生的主要现象填入Ⅱ中。
|
实验要求 |
证明亚硫酸钠氧化变质 |
证明某白色固体中含有NH4+ |
除去铁粉中少量铝粉 |
|
|
答案 |
Ⅰ |
|
|
|
|
Ⅱ |
|
|
|
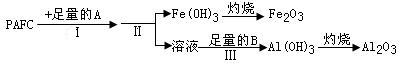 (1)为检测PAFC中
(1)为检测PAFC中
 MnO2+4HCl(浓) MnCl2+2H2O+
Cl2↑制取Cl2。通过计算回答下列问题:
MnO2+4HCl(浓) MnCl2+2H2O+
Cl2↑制取Cl2。通过计算回答下列问题: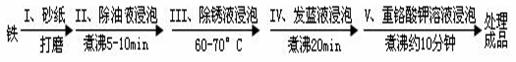
 (10分)无土栽培试验时需要配制两份成分完全相
(10分)无土栽培试验时需要配制两份成分完全相 (1)漂白粉的有效成分是_______________(填化学式).
(1)漂白粉的有效成分是_______________(填化学式).