摘要:17.NO2与Na2O2常温下能反应.反应时何者为氧化剂?两同学开展如下研究. [作出猜想]甲乙同学对反应如何进行有如下猜想: 猜想一:Na2O2+2NO2=2NaNO2+O2↑ 猜想二:2Na2O2+4NO2=4NaNO3 [查阅资料]2Na2O2+2H2O=4NaOH+O2↑ 2NO2+2NaOH=NaNO2+NaNO3+H2O 2NaNO2+2HCl=2NaCl+NO↑+NO2↑+H2O [实验探究]a.按图示实验装置开展实验.实验时.往装置中通入足量的NO2.直至反应停止,b.取反应后玻璃直管中固体物质于试管中进行如下实验.并观察.记录现象: 实验操作 实验现象 [实验结论]现象表明.Na2O2与NO2反应按“猜想二 进行. 回答下列问题: (1)实验时.利用铜与浓硝酸制取NO2.反应方程式为 . (2)装置C的作用是 . (3)根据实验结论.NO2与Na2O2反应时作氧化剂的物质是 . (4)请根据实验目的要求和实验结论.将“实验探究 栏目中的表格填写完整. (5)甲乙同学都认为.不宜直接观察C装置导管口是否有气泡冒出即可判断Na2O2与NO2反应究竟按哪种猜想进行.其原因是 . 第Ⅱ卷
网址:http://m.1010jiajiao.com/timu3_id_206515[举报]
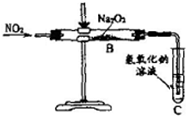 NO2与Na2O2常温下能反应.反应时何者为氧化剂?两同学开展如下研究.
NO2与Na2O2常温下能反应.反应时何者为氧化剂?两同学开展如下研究.【作出猜想】甲乙同学对反应如何进行有如下猜想:
猜想一:Na2O2+2NO2=2NaNO2+O2↑
猜想二:2Na2O2+4NO2=4NaNO3
【查阅资料】2Na2O2+2H2O=4NaOH+O2↑
2NO2+2NaOH=NaNO2+NaNO3+H2O
2NaNO2+2HCl=2NaCl+NO↑+NO2↑+H2O
【实验探究】a.按图示实验装置开展实验.实验时,往装置中通入足量的NO2,直至反应停止;b.取反应后玻璃直管中固体物质于试管中进行如下实验,并观察、记录现象:
| 实验操作 | 实验现象 |
回答下列问题:
(1)实验时,利用铜与浓硝酸制取NO2,反应方程式为
(2)装置C的作用是
(3)根据实验结论,NO2与Na2O2反应时作氧化剂的物质是
(4)请根据实验目的要求和实验结论,将“实验探究”栏目中的表格填写完整.
(5)甲乙同学都认为,不宜直接观察C装置导管口是否有气泡冒出即可判断Na2O2与NO2反应究竟按哪种猜想进行.其原因是
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同
B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强
C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO
D.根据常温下铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2
查看习题详情和答案>>
A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同
B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强
C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO
D.根据常温下铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2
查看习题详情和答案>>
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
- A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同
- B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强
- C.H2CO3的酸性比HClO强,推出COz通入NaClO溶液中能生成HClO
- D.根据铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
(1)S、N、O的的第一电离能由大到小的顺序为 。
(2)SO2、CO、NO2、O3常温下均为气体,固态时均属于 晶体。
(3)随着人们生活质量的提高,室内的环境安全和食品安全越来越为人们所关注。甲醛(HCHO)是室内主要空气污染物之一(其沸点是–19.5 ℃),甲醇(CH3OH)是“假酒”中的主要有害物质(其沸点是64.65 ℃)。甲醛分子中C原子采取 杂化轨道方式。甲醇的沸点明显高于甲醛的主要原因是:
__________ 。
(4)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O,该反应可用于测定空气中CO含量。
①写出铜原子的基态电子排布式 。
②CuCl的晶体结构如下图甲所示,与同一个Cl-距离最近的相邻Cu+有 个。
③Cu(CO)Cl·H2O的结构如上图乙所示,图中标示出8个是共价键,其中 个是配位键,