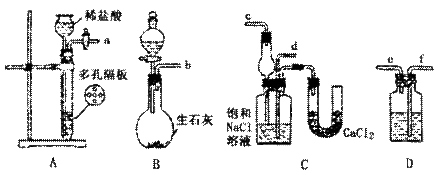
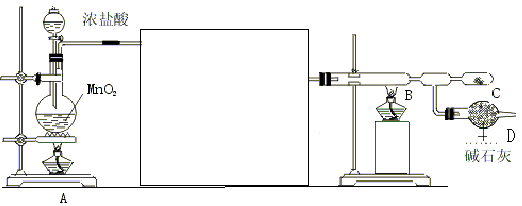
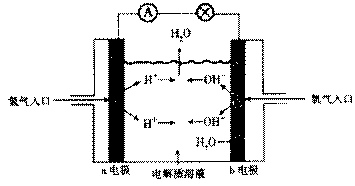
20.(12分)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
(1)根据表中所给数据分析,同主族内不同元素X值的变化规律是__________________________________;简述元素电负性X的大小与元素金属性、非金属性之间的关系 。
(2)预测周期表中电负性最大的元素应为 ,电负性最小的元素为 (放射性元素除外)估计钙元素的电负性的取值范围 < X < 。
(3)验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型 为 ,其理由是 。
19.(10分)某学生用0.1×10×25㎜3,质量分数≥99.5%的铝片和酸反应制取H2,实验现象见下表:
|
|
1min |
2min |
5min |
15min |
20min |
|
3mol/L HCl |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5 mol/LH2SO4 |
均无明显现象(只有少量气泡) |
(1)写出铝片与酸反应的离子方程式 。
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)根据铝片与盐酸和硫酸反应现象的差异,深入思考,可作出如下猜想:
猜想一: 。
猜想二: 。
18.(10分)下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格。
 a
a

 b c
b c
|
序号 |
已知情境 |
写出化学式 |
写出对应反应的离子方程式 |
|
(1) |
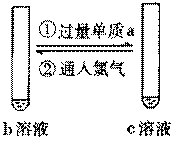 已知b溶液中滴入KSCN溶液后,溶液呈血红色。 |
a |
①_______
_____ ②___ _________ |
|
(2) |
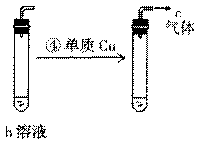 已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5。 |
a_________ b_________ c_________ |
④_____
_____ |
 )
)