32.(16分)根据元素周期表1-18号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧气反应生成的化合物有 __________(填两种化合物的化学式);
(2)属于稀有气体的是___________(填元素符号,下同);
(3原子半径最大的是(稀有气体除外)______________;
(4)气态氢化物最稳定的是 ,推测Si、N气态氢化物的稳定性_________大于_________(填化学式)。
(5)最高价氧化物对应水化物碱性最强的是 ,酸性最强的是 (填化学式),二者分别与Al(OH)3反应的离子方程式为 , 。
33(5分)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
 从实验可以判断:
从实验可以判断:
⑴该固体粉末中一定不含有 ;
⑵该固体粉末中一定含有 和 ;
⑶它的第三种成分只能是______________或 _ ____ ____中的一种。
34(13分)图中每方框内字母表示有关的一种反应物或生成物(生成C时的其他产物或其他反应中生成的水已略去),其中A、F为酸,D、E为盐,C、G为气体。
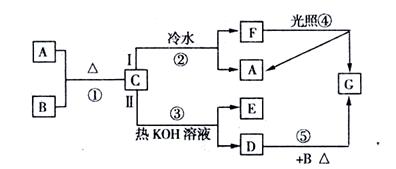
据此,试回答下列有关问题:
(1)写出相应物质的化学式:D ;F ;G 。
(2)写出反应②、③的离子方程式:反应②: ;
反应③: 。
(3)写出反应④、⑤的化学方程式:反应④
反应⑤
(4)a mol C无论按途径Ⅰ,还是按途径Ⅱ,只要完全反应,最终产生G的物质的量均为 mol.
35(14分)在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
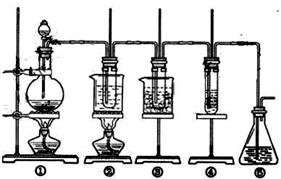 请填写下列空白:
( l )制取氯气时,在烧瓶里加入一定量的二氧化锰,通过__________________(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应的化学方程式为:
请填写下列空白:
( l )制取氯气时,在烧瓶里加入一定量的二氧化锰,通过__________________(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应的化学方程式为:
实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有_________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
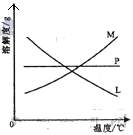 ( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该
晶体溶解度曲线的是_____________________(填写编号字母);从②的试管中分离出该晶体的方法是____________________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:
__________________________________________ _
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为____色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
_______________________________________________ |
|
然后溶液从无色逐渐变为____色 |
_______________________________________________ |
36(7分)把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计).
求:(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
2008-2009学年度下学期第一次调研考试
 第Ⅱ卷(非选择题,共60分)
第Ⅱ卷(非选择题,共60分)