21.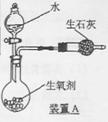
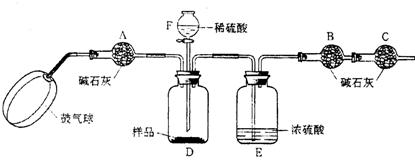
 右图是一种“化学氧自救器”(又称“自生氧防毒面具”),其使用的生氧剂(主要成分是KO2)的作用原理为:4KO2+2CO2=2K2CO3+3O2 某研究小组取100g生氧剂,放人装置A中,加入足量水与生氧剂充分反应(化学方程式为:4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量,他们进行了三次实验。测定结果如下:
右图是一种“化学氧自救器”(又称“自生氧防毒面具”),其使用的生氧剂(主要成分是KO2)的作用原理为:4KO2+2CO2=2K2CO3+3O2 某研究小组取100g生氧剂,放人装置A中,加入足量水与生氧剂充分反应(化学方程式为:4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量,他们进行了三次实验。测定结果如下:
|
测定序号 |
第1次 |
第2次 |
第3次 |
平均值 |
|
反应前装置A总质量(g) |
400.1 |
400.2 |
399.7 |
400.O |
|
反应后装置A总质量(g) |
368.1 |
368.1 |
367.8 |
368.O |
请根据上述实验结果计算:(假设杂质不与水反应产生气体)
(1)100g生氧剂与足量水反应生成的氧气质量;
(2)生氧剂中KO2的质量分数;
(3)若成人每分钟正常需氧量为0.32g,则能维持成人正常呼吸20分钟的“化学氧自救器”,至少要装入这种生氧剂多少克?
 Si + 4HCl 。该反应类型属于( )
Si + 4HCl 。该反应类型属于( )