29.(3分)某无色气体中可能含有甲烷、一氧化碳、二氧化碳、氮气中的一种或几种。现将该气体依次缓缓通过下图所示装置,观察到:①A装置内一直未见有浑浊出现;②D装置内无水硫酸铜变蓝(无水硫酸铜遇水变蓝)。最终收集到一定量干燥气体(假设每步反应以及对气体的吸收都是完全的)。
请回答下列问题:
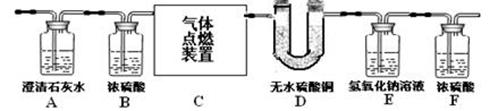
(1)由①可知原混合气体中肯定不含 ▲ (写化学式,下同)。
(2)由②可知原混合气体中一定含有 ▲ 。
|
|
D装置总质量 |
E、F装置总质量 |
|
反应前 |
156.6g |
356.8g |
|
反应后 |
158.4g |
361.2g |
(3)实验过程中记录的实验数据如右表,
则原混合气体的成分为 ▲ 。
 右图是实验室里标签破损的一瓶溶液,只能看清“K”和“O4”。某同学对瓶中溶液是什么作了如下猜想,你认为她的猜想一定不合理的是
右图是实验室里标签破损的一瓶溶液,只能看清“K”和“O4”。某同学对瓶中溶液是什么作了如下猜想,你认为她的猜想一定不合理的是
 下列标志中与消防安全有关的是
下列标志中与消防安全有关的是
 .在许多化学反应中都有能量的变化,这是人类寻找和开发新能源的重要途径之一。在下列物质的变化中基本没有能量变化的是
.在许多化学反应中都有能量的变化,这是人类寻找和开发新能源的重要途径之一。在下列物质的变化中基本没有能量变化的是 
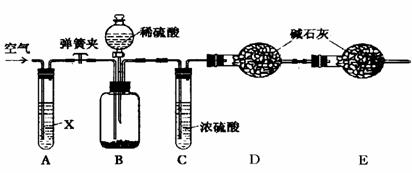
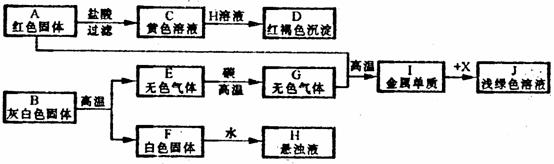
 (8分)Ⅰ.小明设计了右图1所示的实验装置,进行一氧化碳还原
(8分)Ⅰ.小明设计了右图1所示的实验装置,进行一氧化碳还原 Ⅱ.为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了右图2所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞)。
Ⅱ.为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了右图2所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞)。
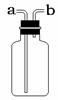 (3)右图所示装置有很多用途。
(3)右图所示装置有很多用途。