2008―2009学年度江苏省靖江市高三联考试卷
化 学 试 卷
考试时间100分钟,满分120分 2008-12
相对原子质量: H―
S-32 Cu-64 Cl-35.5 Na-23 K-39 Ca-40
第I卷 选择题(共48分)
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.
红珊瑚栖息于200~
A. Na B. Fe C. Si D. Cu
2.某炼金厂的废水因暴雨溢出,导致河水严重污染。废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
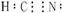 C.在水溶液中(CN)2可被F-还原 D.HCN的电子式为
C.在水溶液中(CN)2可被F-还原 D.HCN的电子式为
3.下列叙述中,错误的是
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH―)增大
D.在纯水中加入少量硫酸铵,可抑制水的电离
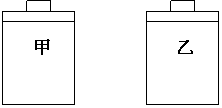 4.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N2O4
4.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N2O4 2NO2 △H >0)
2NO2 △H >0)
(a)将两容器置于沸水中加热
(b)在活塞上都加
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
5.下列离子方程式正确的是
A.60 mL1mol/L 氢氧化钡溶液与15mL2 mol/L 明矾溶液混合:
3Ba2++6OH―+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.60 mL1 mol/L纯碱溶液与20 mL2 mol/L胆矾溶液混合(无气体放出):
3CO32―+2Cu2++2H2O=2HCO3―+Cu2(OH)2CO3↓
C.H2O中投入Na218O2固体:2H2O+218O22―=418OH―+O2↑
D.0.1mol/L CuCl2溶液中加入0.1mol/L NaHS溶液Cu2++2HS―+2H2O=Cu(OH)2↓+2H2S↑
6.在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是
A.K+、Al3+、H2PO4―、SO42- B.Ca2+、NH4+、CO32-、Cl-
C.Na+、K+、NO3-、ClO- D.Na+、Ba2+、I-、SO32-
7.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A.②③④ B.②③④⑤ C.①③④ D.①②③④
8. 常温下,有甲、乙两份体积均为l L,浓度均为0.1mol/L的氨水,其pH为11。①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol/L的盐酸混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=bmol。则a、b正确的答案组合是
A.9~11之间; 0.1 B.9~11之间; 0.2
C.12~13之间; 0.2 D.13; 0.1
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.乙醇、液氨、水都可以发生自偶电离,如H2O + H2O H3O+
+ OH-,
H3O+
+ OH-,
NH3+NH3  NH4++ NH2―,则下列叙述正确的是
NH4++ NH2―,则下列叙述正确的是
A.乙醇的电离方程式:2CH3CH2OH  CH3CH2OH2+
+ CH3CH2O―
CH3CH2OH2+
+ CH3CH2O―
B.液氨的离子积常数为:1.0×10-28,则液氨浓度为1.0×10-14mol/L
C.若可用与pH相当的定义来规定pOH、pNH2-等,则乙醇中与pH相当的为-lgc(CH3CH2OH2+)
D.乙醇中KW = c(CH3CH2OH2+).c(CH3CH2O―)= 1.0 × 10-30,则此时的p CH3CH2O―=-15
10.设NA表示阿伏加德罗常数的数值,下列说法中不正确的是
A.一定量的Fe与1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
 B.
B.
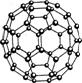
C.N60结构如右图,
D.
 11.一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是
11.一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是
A.储存H2的碳纳米管作电池正极
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:
NiO(OH)+H2O+e-=Ni(OH)2 +OH-
D.放电时,电池反应为2H2+O2=2H2O
12.对于平衡体系:aA(g)+bB(g) cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则起始时A、B的物质的量之比为a :b
C.若平衡体系中共有气体m mol,再向其中充入n molB,达到平衡时气体总物质的量为(m+n)mol,则a+b=c+d
D.若a+b=c+d ,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强不变
13.下列溶液中离子浓度的关系一定正确的是
A.Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.一元弱碱MOH对应的盐MCl溶液中:c(Cl-)>c(H+)>c(M+)>c(OH-)
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
c(M+)=c(X-)>c(H+)=c(OH-)tesoon
 14.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
14.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.正反应一定是吸热反应,且T2>T1
D.b点时,平衡体系中A、B原子数之比接近1∶3
第II卷(非选择题 共72分)
三、(本题包括1小题,共10分)
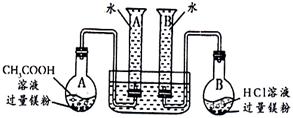 15.(10分)某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去)。
15.(10分)某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去)。
正确操作,记录得到下表中部分实验数据。
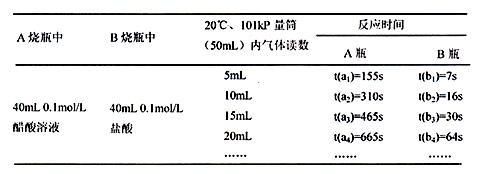
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是 ;
(3)在实验数据中
①t(a1)远远大于t(b1)的原因为: ;
②由 [用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是强酸,不存在电离平衡;由 [用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡。
(4)该实验得到什么结论?(回答出两点即可)
①
②
(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入 (填写两种不同作用原理的物质)。
四、(本题包括2小题,共18分)
16.(8分)“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了下图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物。
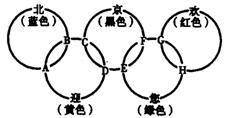
已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1 mol G可与1 mol“您”恰好反应生成1 mol H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅烧可制得A,此反应是工业上制取酸M的基础反应。请回答下列问题:
(1)“京”是 ,“欢”的同素异形体是 。
(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:
,该反应为氧化还原反应,还原产物为 。
(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气中以得到一种化肥,写出该肥料的化学式:
 (4)已知:P(s)+
(4)已知:P(s)+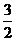 Cl2(g) PCl3(g);△H=-287.7kJ/mol,
Cl2(g) PCl3(g);△H=-287.7kJ/mol,
 P(s)+
P(s)+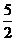 Cl2(g) PCl5(g);△H=-498.7kJ/mol。则PCl5(g)和Cl2(g)反应的热化学方程式为: 。
Cl2(g) PCl5(g);△H=-498.7kJ/mol。则PCl5(g)和Cl2(g)反应的热化学方程式为: 。
17.(10分)利用天然气合成氨的工艺流程示意如下:
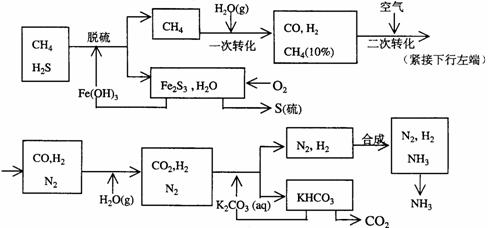
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于
(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)
五、(本题包括1小题,共10分)
18.(10分))污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子配合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生配合反应:Cu2++2 H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式: 。
萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以配合物形式被萃取分离的百分率。
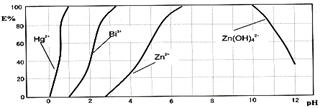
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH=____________________。
(3)当调节pH=2时,铋(Bi)的存在形式有:____________________,其物质的量之比为____________________。
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:________________________________________。
六、(本题包括1小题,共12分)
19.
(12分)配位平衡也是一种相对平衡状态,存在着平衡移动,它同溶液的pH值、沉淀的反应、氧化还原反应等有密切关系,也就是说,在溶液中形成配位物时,常常出现颜色的变化、溶解度的变化、PH值的改变等现象。Br-与Cu2+反应生成配位化合物,就存在配位平衡。 Cu2++ 2Br-  Cu Br2
Cu2++
4Br-
Cu Br2
Cu2++
4Br-  [Cu Br4]
2-
[Cu Br4]
2-
已知:Cu2+在水溶液中显蓝色,[Cu Br4] 2-在水溶液中显黄色,蓝色与黄色并存时显绿色,[Cu Br4] 2-浓度越大,颜色越深。同时,温度可能对[Cu Br4] 2-的稳定性有影响。
某化学探究小组的同学为了探究温度、浓度对Br-与Cu2+的配位平衡的影响,于是做了下列的假设与猜想(填写空缺的假设):
【假设与猜想】
1、增大配位离子(Br-)的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
2、
3、温度变化可能影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。
4、温度变化也可能使化学平衡向左移动,抑制配合物的形成。
【实验准备】
(1)CuSO4溶液的准备:分别取3份
(2)NaBr溶液的准备:分别取
问题1:粗略配制上述溶液需要用到的仪器有:
;
【实验现象】
表1、不同浓度的Br-溶液与某一浓度的Cu2+溶液反应
编号
5 mlCu2+溶液(mol?L-1)
10 ml Br-溶液(mol?L-1)
现象
①
第一份CuSO4溶液
a
溶液由蓝色变为蓝绿色
②
第一份CuSO4溶液
b
溶液由蓝色变为草绿色
③
第一份CuSO4溶液
c
溶液由蓝色变为亮绿色
表2、不同浓度的Cu2+溶液与某一浓度的Br-溶液反应
编号
5 mlCu2+溶液(mol?L-1)
10 ml Br-溶液(mol?L-1)
现象
①
d
第一份NaBr溶液
溶液由蓝色变为蓝绿色
②
e
第一份NaBr溶液
溶液由蓝色变为草绿色
③
f
第一份NaBr溶液
溶液由蓝色变为亮绿色
表3、不同温度对配合物形成的影响
编号
5 mlCu2+溶液(mol?L-1)
10 ml Br-溶液(mol?L-1)
温度
现象
①
第一份CuSO4溶液
第一份NaBr溶液
溶液由蓝色变为蓝绿色
②
第一份CuSO4溶液
第一份NaBr溶液
溶液由蓝色变为草绿色
③
第一份CuSO4溶液
第一份NaBr溶液
溶液由蓝色变为亮绿色
问题2:上表中b= mol/L e= mol/L;
问题3:通过表3得出的结论是 ;
问题4:上述反应根据的原理是 。
七、(本题包括1小题,共10分)
20. (10分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应。实验记录如下:
实验次数
样品质量/g
沉淀质量/g
1
1.716
2.758
2
2.574
3
3.432
5.516
4
4.290
5.516
回答下列问题:
(1)第2次实验中产生沉淀质量是多少,将结果填入表格空白处。
(2)Ba(OH)2溶液中溶质的物质的量浓度是 。
(3)第2次实验样品中NaHCO3的物质的量是 。
(4)室温下取第2组实验所得溶液体积的1/10,加水配成500mL溶液,求稀释以后溶液的pH?(要求书写计算过程)
八、(本题包括1小题,共12分)
21.下表是元素周期表的一部分。
 族
族
周期
I A
II A
III A
IV A
V A
VI A
VII A
一
二
a
b
d
e
三
f
g
h
j
(1)表中元素的单质中熔点最高的可能是___(填元素符号);写出a的氯化物的电子式 ;e、f、h形成的简单离子的半径由大到小顺序依次为______________(填离子符号);
(2)在一定条件下,j与d可形成一种化合物,常温下为淡黄色液体,则其晶体类型为__;该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,写出相关反应的化学方程式___________________________;
(3)现有一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,该元素是表中_____元素(填编号);
(4)在g的单质中添加f单质,形成物质k,则g、f、k中硬度最大的是_____(填物质名称)。
(5)若制得117号元素,按元素周期表中金属与非金属的分区,它应是一种
(选填“金属”“非金属”)元素,写出117号元素最外层电子排布式 。
(6)试用短周期元素,写出两种中心原子杂化轨道类型不同的AB3型分子的化学式
、 。
一:1
B
二;
15. (10分)(1)(1分)量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)。
(2)(2分)容量瓶(100mL);玻璃棒
(3)(1分)①开始阶段醋酸溶液中的C(H+)远小于相同浓度的盐酸中的C(H+)
②(1分)t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
(1分)t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
(其它表示形式只要正确均给分)
(4)(2分)①相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)。
②盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
(5)(2分)CH3COONa固体、水或NaCl溶液
16.(8分)(1)铁 白磷 (2分,)
(2)2FeCl3+SO2+2H2O===H2SO4+2HCl+2FeCl2(2分) FeCl2(1分)
(3) (NH4)2SO4 (1分)
(4)PCl5(g)===Cl2(g)+PCl3(g);△H=+211.0kJ/mol。(2分,)
17(10分)(2分×5)(1)3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)2.7n (3)b
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)
 (5)
(5)
18.(10分)(1)Fe3++3H2Dz Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
(3)Bi3+ Bi(HDz)3 (2分) ;3∶2 (1分);
(4)Zn(HDz)2+6OH-=Zn(OH)4-+2Dz2-+2H2O (2分)
19. (12分)【假设与猜想】
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;(2分)
【实验准备】
问题1:(托盘)天平、烧杯、玻璃棒、量筒;(2分)
【实验现象】
问题2:0.8 1.0(4分)
问题3:温度升高影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。(2分)
问题4:勒沙特列原理(或化学平衡移动原理)。(2分)
20. (10分)(1)4.137 (2分) (2)0.056mol/L (2分) (3)0.006mol (2分)
(4)12 (4分)
21.(12分) (1)C、 Li+ 、 S2-
>F- > Mg2+(各1分,共3分);
、 S2-
>F- > Mg2+(各1分,共3分);
(2)分子晶体(1分),NCl3 + 3 H2O ==NH3 + 3HClO(2分);
(3)e (1分)
(4)铝镁合金(1分)。
(5) 金属(1分) 7s27p5 (1分)
(6)NH3、BF3或其它合理答案(2分)