网址:http://m.1010jiajiao.com/timu_id_173712[举报]
一:1
B
二;
15. (10分)(1)(1分)量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)。
(2)(2分)容量瓶(100mL);玻璃棒
(3)(1分)①开始阶段醋酸溶液中的C(H+)远小于相同浓度的盐酸中的C(H+)
②(1分)t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
(1分)t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
(其它表示形式只要正确均给分)
(4)(2分)①相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)。
②盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
(5)(2分)CH3COONa固体、水或NaCl溶液
16.(8分)(1)铁 白磷 (2分,)
(2)2FeCl3+SO2+2H2O===H2SO4+2HCl+2FeCl2(2分) FeCl2(1分)
(3) (NH4)2SO4 (1分)
(4)PCl5(g)===Cl2(g)+PCl3(g);△H=+211.0kJ/mol。(2分,)
17(10分)(2分×5)(1)3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)2.7n (3)b
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)
 (5)
(5)
18.(10分)(1)Fe3++3H2Dz Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
(3)Bi3+ Bi(HDz)3 (2分) ;3∶2 (1分);
(4)Zn(HDz)2+6OH-=Zn(OH)4-+2Dz2-+2H2O (2分)
19. (12分)【假设与猜想】
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;(2分)
【实验准备】
问题1:(托盘)天平、烧杯、玻璃棒、量筒;(2分)
【实验现象】
问题2:0.8 1.0(4分)
问题3:温度升高影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。(2分)
问题4:勒沙特列原理(或化学平衡移动原理)。(2分)
20. (10分)(1)4.137 (2分) (2)0.056mol/L (2分) (3)0.006mol (2分)
(4)12 (4分)
21.(12分) (1)C、 Li+ 、 S2-
>F- > Mg2+(各1分,共3分);
、 S2-
>F- > Mg2+(各1分,共3分);
(2)分子晶体(1分),NCl3 + 3 H2O ==NH3 + 3HClO(2分);
(3)e (1分)
(4)铝镁合金(1分)。
(5) 金属(1分) 7s27p5 (1分)
(6)NH3、BF3或其它合理答案(2分)
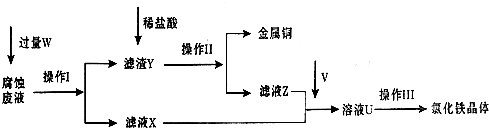
(1)请写出FeCl3溶液与铜反应的离子方程式:
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,并进行有关实验.
①需要量取浓盐酸
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:
| ||
| ||
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为
①混合后溶液的pH=8的原因(用离子方程式表示):
②水电离出的c(H+):混合溶液
③已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各种离子的浓度以它们化学计量数为次方的乘积叫溶度积常数(Ksp). 例如:Cu(OH)2?Cu2++2OH-,Ksp=c(Cu2+)?c(OH-)2=2×10-20.当溶液中各种离子的浓度次方的乘积大于溶度积时,则产生沉淀,反之固体溶解.
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2 沉淀,应调整溶液的pH>5,原因是(用数据说明)
②要使0.2mol/LCuSO4溶液中Cu2+ 沉淀较为完全(即使Cu2+ 浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH≥多少?写出计算过程:
已知:Cu2+在水溶液中显蓝色,[Cu Br4]2-在水溶液中显黄色,蓝色与黄色并存时显绿色,[Cu Br4]2-浓度越大,颜色越深.同时,温度可能对[Cu Br4]2-的稳定性有影响.
某化学探究小组的同学为了探究温度、浓度对Br-与Cu2+的配位平衡的影响,于是做了下列的假设与猜想(填写空缺的假设):
[假设与猜想]
1、增大配位离子(Br-)的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
2、______.
3、温度变化可能影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动.
4、温度变化也可能使化学平衡向左移动,抑制配合物的形成.
[实验准备]
(1)CuSO4溶液的准备:分别取3份8g无水CuSO4固体,各加入水稀释到100ml、50ml、25ml(第三种溶液已饱和);
(2)NaBr溶液的准备:分别取2.06g、4.12g、4.12gNaBr晶体,各加入水稀释到50ml、50ml、25ml.
问题1:粗略配制上述溶液需要用到的仪器有:______;
表1、不同浓度的Br-溶液与某一浓度的Cu2+溶液反应
| 编号 | 5mlCu2+溶液 | 10ml Br-溶液 | 现象 |
| ① | 第一份CuSO4溶液 | a | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | b | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由蓝色变为亮绿色 |
| 编号 | 5mlCu2+溶液 | 10ml Br-溶液 | 现象 |
| ① | d | 第一份NaBr溶液 | 溶液由蓝色变为蓝绿色 |
| ② | e | 第一份NaBr溶液 | 溶液由蓝色变为草绿色 |
| ③ | f | 第一份NaBr溶液 | 溶液由蓝色变为亮绿色 |
| 编号 | 5mlCu2+溶液 | 10ml Br-溶液 | 温度 | 现象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由蓝色变为亮绿色 |
问题3:通过表3得出的结论是______;
问题4:上述反应根据的原理是______.
查看习题详情和答案>>
(1)工业上有一种生产甲醇的反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
在某温度下,容积均为1L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |
②该温度下,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 的化学平衡常数的值为
③a=
④下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1:
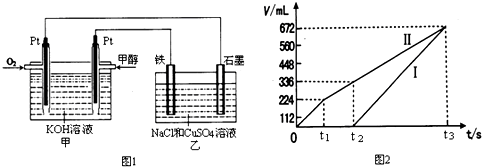
①写出甲中通入甲醇一极的电极反应式
②图2中曲线Ⅰ、Ⅱ分别表示乙中两极所得气体的体积随时间变化的关系(气体体积已换算成标准状况下的体积),写出电解开始时铁极上的电极反应式
t1后石墨电极上的电极反应式
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:

请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3 饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。

Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)
 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。