网址:http://m.1010jiajiao.com/timu_id_173699[举报]
一:1
B
二;
15. (10分)(1)(1分)量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)。
(2)(2分)容量瓶(100mL);玻璃棒
(3)(1分)①开始阶段醋酸溶液中的C(H+)远小于相同浓度的盐酸中的C(H+)
②(1分)t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
(1分)t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
(其它表示形式只要正确均给分)
(4)(2分)①相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)。
②盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
(5)(2分)CH3COONa固体、水或NaCl溶液
16.(8分)(1)铁 白磷 (2分,)
(2)2FeCl3+SO2+2H2O===H2SO4+2HCl+2FeCl2(2分) FeCl2(1分)
(3) (NH4)2SO4 (1分)
(4)PCl5(g)===Cl2(g)+PCl3(g);△H=+211.0kJ/mol。(2分,)
17(10分)(2分×5)(1)3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)2.7n (3)b
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)
 (5)
(5)
18.(10分)(1)Fe3++3H2Dz Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
(3)Bi3+ Bi(HDz)3 (2分) ;3∶2 (1分);
(4)Zn(HDz)2+6OH-=Zn(OH)4-+2Dz2-+2H2O (2分)
19. (12分)【假设与猜想】
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;(2分)
【实验准备】
问题1:(托盘)天平、烧杯、玻璃棒、量筒;(2分)
【实验现象】
问题2:0.8 1.0(4分)
问题3:温度升高影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。(2分)
问题4:勒沙特列原理(或化学平衡移动原理)。(2分)
20. (10分)(1)4.137 (2分) (2)0.056mol/L (2分) (3)0.006mol (2分)
(4)12 (4分)
21.(12分) (1)C、 Li+ 、 S2-
>F- > Mg2+(各1分,共3分);
、 S2-
>F- > Mg2+(各1分,共3分);
(2)分子晶体(1分),NCl3 + 3 H2O ==NH3 + 3HClO(2分);
(3)e (1分)
(4)铝镁合金(1分)。
(5) 金属(1分) 7s27p5 (1分)
(6)NH3、BF3或其它合理答案(2分)
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2


根据上图回答下列问题:
(1)PCl5分解成PCl3和Cl2的热化学方程式是
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5原因是
(3)P和Cl2分两步反应生成1mol PCl5的△H3=

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式
| 3 |
| 2 |
| 3 |
| 2 |
(2)PCl5分解成PCl3和Cl2的热化学方程式
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是
(4)P和Cl2分两步反应生成1molPCl5的△H3=
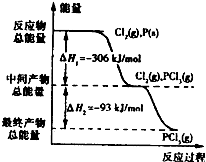 如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )
如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )| A、α等于25% | B、若升高温度,平衡时PCl5的分解率小于α | C、若初始时加入0.6mol PCl3和0.6 mol Cl2,以相同条件进行反应,则平衡时PCl3转化率为3α | D、PCl5分解的热化学方程式为:PCl5(g)?PCl3(g)+Cl2(g)△H=-93kJ?mol-1 |
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).据此回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).据此回答下列问题: