网址:http://m.1010jiajiao.com/timu_id_173698[举报]
一:1
B
二;
15. (10分)(1)(1分)量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)。
(2)(2分)容量瓶(100mL);玻璃棒
(3)(1分)①开始阶段醋酸溶液中的C(H+)远小于相同浓度的盐酸中的C(H+)
②(1分)t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
(1分)t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
(其它表示形式只要正确均给分)
(4)(2分)①相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)。
②盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
(5)(2分)CH3COONa固体、水或NaCl溶液
16.(8分)(1)铁 白磷 (2分,)
(2)2FeCl3+SO2+2H2O===H2SO4+2HCl+2FeCl2(2分) FeCl2(1分)
(3) (NH4)2SO4 (1分)
(4)PCl5(g)===Cl2(g)+PCl3(g);△H=+211.0kJ/mol。(2分,)
17(10分)(2分×5)(1)3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)2.7n (3)b
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)
 (5)
(5)
18.(10分)(1)Fe3++3H2Dz Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
Fe(HDz)3+3H+ (2分) 。Fe3+ 会形成Fe(OH)3沉淀 (2分);(2)1 (1分);
(3)Bi3+ Bi(HDz)3 (2分) ;3∶2 (1分);
(4)Zn(HDz)2+6OH-=Zn(OH)4-+2Dz2-+2H2O (2分)
19. (12分)【假设与猜想】
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;(2分)
【实验准备】
问题1:(托盘)天平、烧杯、玻璃棒、量筒;(2分)
【实验现象】
问题2:0.8 1.0(4分)
问题3:温度升高影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动。(2分)
问题4:勒沙特列原理(或化学平衡移动原理)。(2分)
20. (10分)(1)4.137 (2分) (2)0.056mol/L (2分) (3)0.006mol (2分)
(4)12 (4分)
21.(12分) (1)C、 Li+ 、 S2-
>F- > Mg2+(各1分,共3分);
、 S2-
>F- > Mg2+(各1分,共3分);
(2)分子晶体(1分),NCl3 + 3 H2O ==NH3 + 3HClO(2分);
(3)e (1分)
(4)铝镁合金(1分)。
(5) 金属(1分) 7s27p5 (1分)
(6)NH3、BF3或其它合理答案(2分)
已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,并知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是(?? )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看习题详情和答案>>
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |
已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,并知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( )
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是(?? )
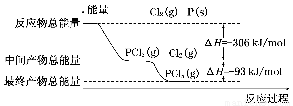
A.其他条件不变,升高温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热 ΔH=-798 kJ/mol
C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)=2PCl3(g) ΔH=-306 kJ/mol
D.其他条件不变,对于2PCl5(g)=2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
查看习题详情和答案>>

| A.其他条件不变,升高温度有利于PCl5的生成 |
| B.反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热 ΔH=-798 kJ/mol |
| C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)=2PCl3(g) ΔH=-306 kJ/mol |
| D.其他条件不变,对于2PCl5(g)=2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小 |