2009年高考化学实验题预测
山东省平邑县第二中学 杨 坤
新课程理念下高考试题注重突出了能力考查,而高考试题中的实验题无疑成为综合考查学生能力的首选题型之一。纵观近两年各地高考的化学试卷(包括理综卷化学试题),无一卷中不考查化学实验题。2009年的《考试大纲》中在对学生的能力要求中又明确提出了“化学实验和探究能力”,可见该类试题必是高考的必考题型。因此认真研究领悟高考化学实验试题的特点,对提高高考成绩将大有帮助,本文下面将结合近两年高考化学实验试题的命题特点和趋势,对2009年高考化学实验题题型作出如下预测。
一、试题注重对化学基本实验知识的考查,引导高中教学重视对学生实验操作能力的培养
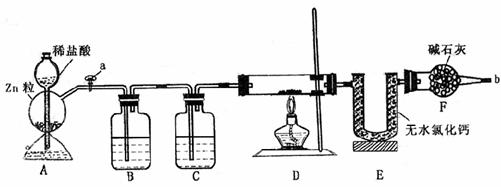
1.(7分)某化学小组的同学到实验室学习。在实验桌上摆有下列仪器:
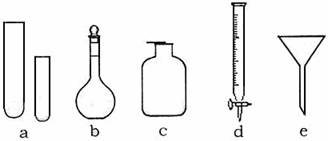
(1)甲同学想用d进行实验,请你说出该仪器(已经洗涤干净)使用时的第一步操作: 。
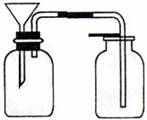 (2)关于e的用途,乙同学说:组成防倒装置。你还能说出其
(2)关于e的用途,乙同学说:组成防倒装置。你还能说出其
他两种用途吗?
① ;② 。
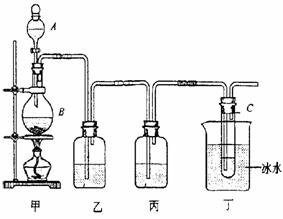
(3)丙同学想用右图装置以大理石和稀盐酸反应制取CO2。
教师指出,这需要太多的稀盐酸,造成浪费。该同学
选用了上面的一种仪器,加在装置上,解决了这个问题。
请你把该仪器画在图中合适的位置。
解析:本题考查了酸式滴定管、漏斗等仪器的使用以及CO2的制取等基本操作,同时试题中还渗透着实验的设计,是一道全面考查学生实验基本知识的试题。(1)仪器d为酸式滴定管,使用时应先检查是否漏液或利用以洗涤干净的滴定操作时,应先用待装液体润洗2~3次。(2)仪器e为短颈普通漏斗,其常用用途有倒置在液面上,组成防倒装置,还有往细口容器中加液体以及与滤纸组成过滤装置等。(3)为节约药品,结合给出的仪器,只有试管可做为反应器,故可在漏斗颈口下端接试管来代替广口瓶做反应器。或将大理石药品置于光口瓶底部,在漏斗下端连接一试管,想试管中加盐酸直至溢出,这样待反应后试管中盐酸没有污染,仍可利用。当然两装置中还必须注意液封。
答案:(1)用待装液润洗酸式滴定管2~3次(也可以写:检查酸式滴定管是否漏水)
(2分)(2)①往细口容器中加液体;②组成过滤装置(只要答对两个即可,其它合理答案亦可)(每空1分,共2分)
(3)
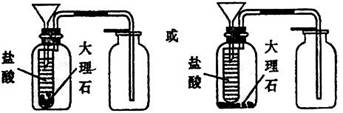
(只需画对试管的位置即可得分) (3分)
二、试题注重了对定性和定量实验进行综合考查,落实《考纲》中“分析问题和解决(解答)化学问题的能力”的能力要求
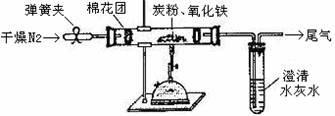
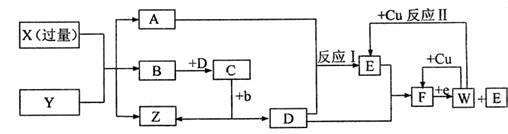
2.(16分)我国化工专家侯德榜的“侯氏制碱法”曾为世界碱业作出了突出贡献。他利用NaHCO3、NaC1、NH
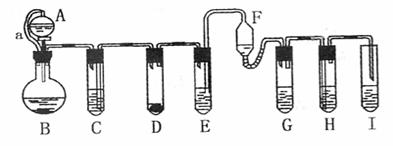
I.某课外兴趣小组的甲同学在实验室中,用下列装置模拟“侯氏制碱法”制取NaHCO3,其实验步骤为:
①连接好装置,检验气密性,在仪器内装人药品。
②先让一装置发生反应,直到产生的气体不能再在c中溶解时,再通人另一装置中产生的气体。片刻后,C中出现固体,继续向C中通入两种气体,直到不再有固体产生。
③过滤C中所得的混合物,得到NaHCO3固体.
④向滤液中加人适量的NaC1粉末有NH

请完成下列各问:
(1)装置的连接顺序是:a接 、 接 ;b接 。
(2)D中所选用的液体为 ;C中用球型干燥管而不用直导管,其作用是 ;
④中分离NH
(3)请简述用浓氨水和生石灰能制收NH3的原因 。
(4)写出C中广口瓶内产生固体的总化学反应方程式 。
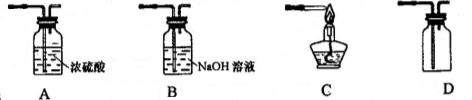
(5)下列设计测定Na2CO3质量分数的装量中,正确的是 (填序号)。
|
 NH3?H2O
NH3?H2O