摘要:解析:本题以常见碳与氧化铁的反应为知识背景.通过实验探究的形式.综合考查了探究实验的分析.评价.改进实验方案等以及数据的处理.分析能力.该类试题将是今后实验命题的趋势. (3)由题中信息知N2的NH4+与NO2-中N元素间的归中反应.故离子方程式为:NH4++NO2-=N2↑+2H2O ,(4)由参加反应的碳.氧的质量比1:2可推知其物质的量之比为:n=2:3.与CO2中碳.氧物质的量之比1:2不符.可见产物一定不是CO2,(6)由参与反应的碳.氧物质的量的比推知得到的气体产物是CO和CO2的混合物.且CO和CO2的物质的量之比为1:1.故可写出反应方程式:略.(7)因气体产物中混有有毒气体CO.应进行尾气处理.处理方法可利用CO的可燃性.采用点燃法.故可在原装置最后连接上C装置来处理CO. 答案:(3)NH4++NO2-=N2↑+2H2O (5)反应后的气体中碳.氧原子的物质的量之比为2:3.与二氧化碳中碳.氧原子的物质的量比不相符 20090506 (7)在原装置最后连接上C装置 及时训练
网址:http://m.1010jiajiao.com/timu_id_116455[举报]
1.(16分)
(1)①洗去油污(1分);③在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤(1分);④将③的滤渣溶入足量的稀硫酸中,过滤,滤液保留待用(1分);(2)⑤、③(1分),将溶液加热到
(3)否(1分),普通自来水中含Cl―,使Ag+被沉淀(1分)。 (共2分)
(4)Fe+2Ag+
Fe2++2Ag,Fe2O3+6H+ 2Fe3++3H2O,Fe+2Fe3+ 3Fe2+,
Fe+2H+ Fe2++H2↑
(各1分,共4分)
(5)抑制Fe2+的水解,防止Fe2+被氧化 (2分)
2.(10分)(1)MnO2, NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2==== NaCl+NaClO+H2O (2分)
(3)①不能(1分),HCl气体进入C中,消耗NaOH, 降低NaClO的纯度。(2分)(共3分)




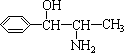 (10分)目前,包括我国在内的许多国家都已经暂停销售和使用含苯丙醇胺的药品制剂。苯丙醇胺的英文名称是Phenylpropanolamine,
(10分)目前,包括我国在内的许多国家都已经暂停销售和使用含苯丙醇胺的药品制剂。苯丙醇胺的英文名称是Phenylpropanolamine,
 。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
