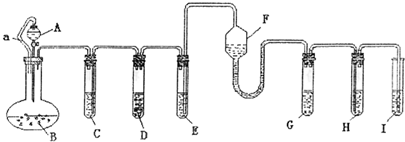
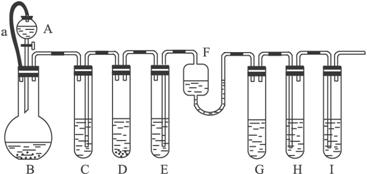
摘要:各装置中试剂或物质分别是:(A)2mol/L H2SO4 2mol/L H2SO4+CuSO4 CuSO4溶液 (F)NH3?H2O (G)30% H2O2(H)H2S溶液 (I)NaOH溶液.已知:Cu2++4NH3?H2O====[Cu(NH3)4]2+4H2O.该反应的产物可作为H2O2分解的催化剂.请回答下列问题: (1)进行实验前必须进行的操作是 (2)B与D两容器中反应速率相比较:B D(填“> .“< 或“= ).其原因是 (3)H中的现象是 (4)I的作用是 (5)A和B之间的导管a的作用是 (6)在该反应中不涉及的反应类型是 ①化合反应 ②分解反应 ③置换反应 ④复分解反应
网址:http://m.1010jiajiao.com/timu_id_116478[举报]
1.(16分)
(1)①洗去油污(1分);③在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤(1分);④将③的滤渣溶入足量的稀硫酸中,过滤,滤液保留待用(1分);(2)⑤、③(1分),将溶液加热到
(3)否(1分),普通自来水中含Cl―,使Ag+被沉淀(1分)。 (共2分)
(4)Fe+2Ag+
Fe2++2Ag,Fe2O3+6H+ 2Fe3++3H2O,Fe+2Fe3+ 3Fe2+,
Fe+2H+ Fe2++H2↑
(各1分,共4分)
(5)抑制Fe2+的水解,防止Fe2+被氧化 (2分)
2.(10分)(1)MnO2, NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2==== NaCl+NaClO+H2O (2分)
(3)①不能(1分),HCl气体进入C中,消耗NaOH, 降低NaClO的纯度。(2分)(共3分)