摘要:8请你帮助乙同学完成下列内容: (1)乙同学对产生上述现象原因的预测之一是:加热时NaHCO3受热分解生成了Na2CO3.原因预测之二是 . (2)查阅资料发现NaHCO3的分解温度为150℃.由此判断.乙同学对第一种情况的预测是 .判定预测二的方法是 .解析:本实验将定性分析和定量考查进行了有效融合.可很好的考查分析或处理实验数据.得出合理结论以及知识迁移和再加工的能力. Ⅰ.由模拟实验的目的.结合NH3和CO2在饱和NaCl溶液中的溶解度的差异知.应先向饱和NaCl溶液中通入NH3至饱和.然后再通入CO2.这样可吸收大量的CO2.利于形成NaHCO3.结合装置可知A装置产生CO2中常混有HCl.应通入D装置中洗气.除去CO2中混有的HCl杂质后在通入C装置,装置B产生NH3可直接通入C装置.但因NH3极易溶解.应防止倒吸.故应接c(靠干燥管的球形部分防倒吸).故装置的连接顺序为:a→f→e→d,b→c.(5)本实验是通过测量液体的体积求出一定量的Na2CO3样品产生CO2的体积.进而求出Na2CO3样品的纯度.装置A.B是长进短出.故无法排出液体,D中Na2CO3可与CO2作用.故应选C装置.Ⅱ.(1)pH升高的另一原因是促进了HCO3-的水解,(2)因NaHCO3分解需要150℃.故在煮沸的条件下.NaHCO3不分解.所以预测一不正确,可利用再将热溶液冷却至30℃.20℃或10℃.看溶液的pH.从而判断预测二的正误. 答案:I.(1)f e d c (2)饱和NaHCO3溶液 .防止发生倒吸 (3)生石灰与水反应.放出大量热.生成物是强碱.都使
网址:http://m.1010jiajiao.com/timu_id_116447[举报]
1.(16分)
(1)①洗去油污(1分);③在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤(1分);④将③的滤渣溶入足量的稀硫酸中,过滤,滤液保留待用(1分);(2)⑤、③(1分),将溶液加热到
(3)否(1分),普通自来水中含Cl―,使Ag+被沉淀(1分)。 (共2分)
(4)Fe+2Ag+
Fe2++2Ag,Fe2O3+6H+ 2Fe3++3H2O,Fe+2Fe3+ 3Fe2+,
Fe+2H+ Fe2++H2↑
(各1分,共4分)
(5)抑制Fe2+的水解,防止Fe2+被氧化 (2分)
2.(10分)(1)MnO2, NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2==== NaCl+NaClO+H2O (2分)
(3)①不能(1分),HCl气体进入C中,消耗NaOH, 降低NaClO的纯度。(2分)(共3分)




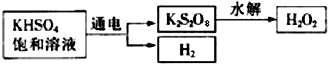
 某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究. CO2↑+2SO2↑+2H2O)
CO2↑+2SO2↑+2H2O)