太原市2009年高三基础知识测试
化 学 试 卷
(考试时间:10:00―12:00)
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,答题时间120分钟,满分150分。
注意事项:
1.答第Ⅰ卷前,考生务必用蓝、黑色墨水笔或圆珠笔将姓名、考试证号填在答题卡上,并用2B铅笔在答题卡上规定位置涂黑自己的考试证号和考试科目。
2.每小题选出答案后,用铅笔涂黑答题卡上对应题目的答案标号。如需改动,用橡皮擦干净后,再选涂其他答案。答案写在试题卷上无效。
可能用到的相对原子质量: 1
1  12
12  14
14  16
16  23
23  27
27  32
32 

 64
64  56
56
第Ⅰ卷 (选择题 共71分)
一、选择题(本题包括17小题,每小题3分,共51分。每小题只有一个选项符合题意。请将正确选项的序号涂在机读卡上)
1.下列说法摘自一些科普杂志或广告用语,你认为有科学性错误的是( )S
A.糖类、油脂和蛋白质都是天然的有机化合物
B.医学上可用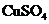 溶液和
溶液和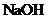 溶液检验糖尿病人尿液中的葡萄糖
溶液检验糖尿病人尿液中的葡萄糖
C.“白雪牌”漂白粉,可令所有化学物质黯然失色,没有最白,只有更白
D.甲醛是某些劣质装饰板材释放的常见污染物之一
2.下列分子中所有原子都满足最外层为8电子结构的是( )
A. B.
B.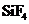 C.
C.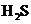 D.
D.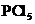
3.随着科学技术的不断进步,研究物质的手段和途径越来越多,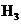 、
、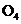 、
、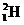 、
、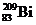 等已被发现。下列有关说法中,正确的是( )
等已被发现。下列有关说法中,正确的是( )
A.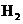 与
与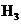 互为同素异形体 B.
互为同素异形体 B.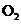 与
与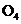 属于同位素
属于同位素
C.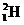 与
与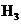 互为同素异形体 D.
互为同素异形体 D.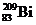 含有126个质子
含有126个质子
4.高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
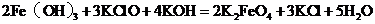 ,下列说法正确的是( )
,下列说法正确的是( )
A.制高铁酸钾用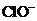 做还原剂
做还原剂
B.制备高铁酸钾时
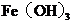 得到
得到 电子
电子
C.高铁酸钾中铁的化合价为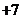
D.用高铁酸钾处理水时,用到了其强氧化性,且其还原产物能水解产生具有强吸附能力的胶体
5.实验室保存下列药品的方法,正确的是( )
A.氢氟酸贮存细口玻璃瓶里
B.浓硝酸应盛放在棕色试剂瓶中并置于黑暗且温度低的地方
C.溴盛放在带有橡皮塞的试剂瓶里,并加一些水来防止溴挥发
D.少量碱金属单质都保存在煤油中;液氯贮存在钢瓶里
6.表示下列变化的化学用语正确的是( )
A.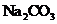 的水解:
的水解: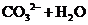
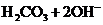
B.用石墨电极电解硫酸铜溶液: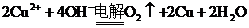
C.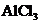 溶液中加入过量氨水:
溶液中加入过量氨水: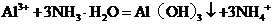
D.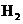 的燃烧热为
的燃烧热为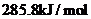 :
: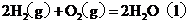 ;
;
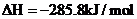
7.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.滴加石蕊试液显红色的溶液: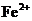 、
、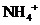 、
、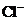 、
、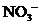
B.常温下,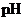 为11的溶液:
为11的溶液: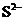 、
、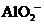 、
、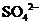 、
、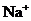
C.水电离出来的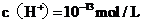 的溶液:
的溶液: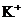 、
、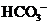 、
、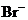 、
、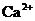
D.无色溶液: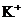 、
、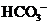 、
、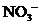 、
、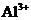
8.25℃时,水的电离达到平衡: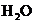

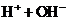 ;
;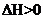 。下列叙述正确的是( )
。下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,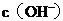 降低
降低
B.向水中加入少量固体硫酸氢钠,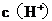 增大,
增大,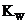 不变
不变
C.向水中加入少量固体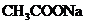 ,平衡逆向移动,
,平衡逆向移动,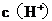 降低
降低
D.将水加热,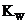 增大,
增大,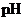 不变
不变
9.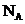 代表阿伏加德罗常数,下列说法正确的是( )
代表阿伏加德罗常数,下列说法正确的是( )
A.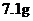
 与足量
与足量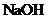 溶液反应转移的电子数为
溶液反应转移的电子数为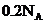
B.标准状况下,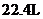 己烷中共价键数目为
己烷中共价键数目为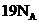
C.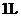 、
、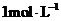 的
的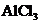 溶液中含有
溶液中含有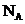 个
个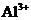
D.常温常压下,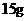 甲基
甲基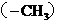 所含电子数为
所含电子数为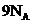
10.已知中学化学中常见反应形式为: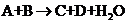 ,对于该反应的下列叙述不正确的是( )
,对于该反应的下列叙述不正确的是( )
A.该反应可能是氧化还原反应 B.该反应可能是非氧化还原反应
C.C和D有一种一定是盐 D.A和B不一定是酸或碱
11.下表为元素周期表中短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )

A.D在过量的B中燃烧的主要产物为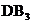
B.C的氢化物的沸点比E的氢化物的沸点高
C.A与B形成的阴离子可能有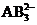 、
、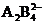
D.由这五种元素中的几种形成的只含极性键的非极性分子不少于4种
D.溶液中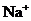 向镁片方向定向移动
向镁片方向定向移动
13.镍镉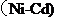 可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为
可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为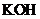 溶液,其充、放电按下式进行:
溶液,其充、放电按下式进行:
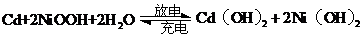

有关该电池的说法正确的是( )
A.充电时阳极反应: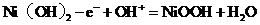
 B.充电过程是化学能转化为电能的过程
B.充电过程是化学能转化为电能的过程
 C.放电时负极附近溶液的碱性不变
C.放电时负极附近溶液的碱性不变
 D.放电时电解质溶液中的
D.放电时电解质溶液中的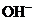 向正极移动
向正极移动
 14.向一定量
14.向一定量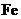 、
、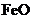 、
、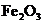 的混合物中加入
的混合物中加入
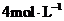 的稀硝酸恰好使混合物完全溶解,放出
的稀硝酸恰好使混合物完全溶解,放出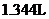 (标准状况)气体,往所得溶液中加入
(标准状况)气体,往所得溶液中加入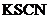 溶液,无血红色出现。若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )
溶液,无血红色出现。若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )
 A.
A.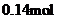 B.
B.
 C.
C.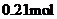 D.
D.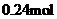
 15.常温下,取物质的量浓度相同的
15.常温下,取物质的量浓度相同的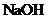 和
和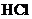 溶液,以
溶液,以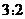 体积比相混合,所得溶液的
体积比相混合,所得溶液的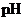 等于12,则原溶液的浓度为( )
等于12,则原溶液的浓度为( )
 A.
A. B.
B.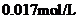 C.
C.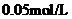 D.
D.
 16.在一定条件下,将
16.在一定条件下,将
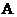 和
和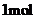
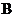 两种气体混合于固定容积为
两种气体混合于固定容积为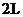 的密闭容器中,发生如下反应:
的密闭容器中,发生如下反应:

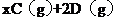 。
。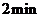 末该反应达到平衡,生成
末该反应达到平衡,生成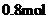
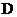 ,并测得
,并测得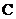 的浓度为
的浓度为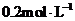 。下列判断错误的是( )
。下列判断错误的是( )
 A.
A.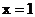
 B.
B.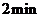 内
内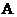 的反应速率为
的反应速率为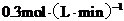
 C.
C.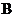 的转化率为
的转化率为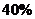
 D.若混合气体的密度不变,则表明该反应已达到平衡状态
D.若混合气体的密度不变,则表明该反应已达到平衡状态
 17.下列实验操作中,正确的是( )
17.下列实验操作中,正确的是( )
 A.称取
A.称取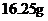
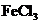 ,用
,用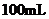 蒸馏水溶解,配制
蒸馏水溶解,配制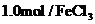 溶液
溶液
 B.为测定硫酸铜晶体中结晶水含量,称样时,先称取一定量的晶体,后放入坩埚
B.为测定硫酸铜晶体中结晶水含量,称样时,先称取一定量的晶体,后放入坩埚
 C.为检验酸性溶液中的
C.为检验酸性溶液中的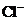 和
和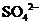 ,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
 D.向乙酸乙酯中加入饱和
D.向乙酸乙酯中加入饱和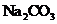 溶液,振荡,分液,除去乙酸乙酯中的少量乙酸
溶液,振荡,分液,除去乙酸乙酯中的少量乙酸
 二、选择题(本题共5小题,每小题4分,共20分。每小题只有一个选项符合题意。)
二、选择题(本题共5小题,每小题4分,共20分。每小题只有一个选项符合题意。)
 18.常温下,
18.常温下,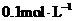 某一元酸
某一元酸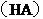 溶液中
溶液中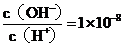 ,下列叙述正确的是( )
,下列叙述正确的是( )
 A.该溶液中由水电离出的
A.该溶液中由水电离出的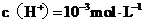
 B.该溶液中
B.该溶液中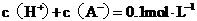
 C.该溶液与
C.该溶液与
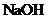 溶液等体积混合后所得溶液中
溶液等体积混合后所得溶液中

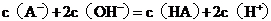
 D.向该溶液中加入一定量的水,溶液中离子的浓度均减小
D.向该溶液中加入一定量的水,溶液中离子的浓度均减小

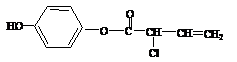
 19.有机物
19.有机物 的结构简式为:
,下列有关
的结构简式为:
,下列有关 的叙述正确的是( )
的叙述正确的是( )
 A.可与
A.可与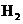 反应,
反应,
 最多消耗
最多消耗
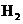
 B.可与浓溴水反应,
B.可与浓溴水反应,
 最多消耗
最多消耗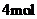
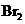 N
N
 C.可与
C.可与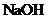 溶液反应,
溶液反应,
 最多消耗
最多消耗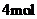
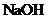
 D.常温下,
D.常温下, 在水中的溶解度大于苯酚在水中的溶解度
在水中的溶解度大于苯酚在水中的溶解度
 20.甲、乙两烧杯中分别盛有
20.甲、乙两烧杯中分别盛有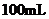 浓度均为
浓度均为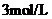 的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成气体的体积之比是
的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成气体的体积之比是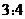 ,则加入铝粉的质量为( )
,则加入铝粉的质量为( )
 A.
A.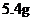 B.
B.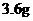 C.
C.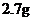 D.
D.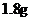
21.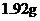 铜投入一定量的浓
铜投入一定量的浓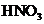 中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下
中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下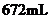 气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的
气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的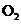 恰好使气体完全溶于水中,则通入
恰好使气体完全溶于水中,则通入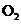 的体积是( )
的体积是( )
A. B.
B.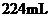 C.
C.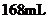 D.
D.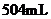
22.下列关系图中,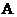 是一种正盐,
是一种正盐,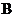 是气态氢化物,
是气态氢化物,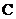 是单质,
是单质,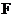 是强酸。当
是强酸。当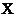 无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去)。当
无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去)。当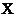 是强碱时过量的
是强碱时过量的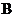 跟
跟 反应除生成
反应除生成 外,另一产物是盐酸盐。下列说法中不正确的是( )
外,另一产物是盐酸盐。下列说法中不正确的是( )
A.当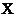 是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是
是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是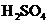
B.当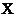 是强碱时,A、B、C、D、E、F中均含同一种元素,F是
是强碱时,A、B、C、D、E、F中均含同一种元素,F是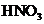
C.B和 发生的反应是氧化还原反应
发生的反应是氧化还原反应
D.当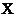 是强酸时,C在常温下是气态单质
是强酸时,C在常温下是气态单质
第Ⅱ卷 (非选择题 共79分)
注意事项:
1.用钢笔或圆珠笔直接答在试题卷中。
2.答卷前将密封线内项目填写清楚。
题号
三
四
Ⅱ卷总分
23
24
25
26
27
28
29
得分
得分
评卷人
三、(本题包括3小题,共32分)
23.(8分)
在一定条件下,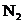 和
和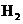 发生如下反应:
发生如下反应:
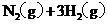

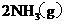 ;
;
(1)该反应中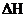 的含义是(填序号):
。
的含义是(填序号):
。
①该反应达到平衡时放出的热量
②该反应达到平衡时吸收的热量
③该条件下,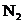 与
与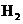 反应生成
反应生成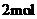
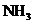 时放出的热量
时放出的热量
④该条件下,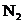 与
与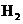 反应生成
反应生成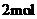
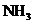 时吸收的热量
时吸收的热量
(2)达到平衡后,在其他条件不变的情况下降低温度,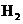 的转化率
,化学反应速率
(填“增大”、“减小”或“不变”)。
的转化率
,化学反应速率
(填“增大”、“减小”或“不变”)。
(3)在甲、乙两个容积相等且固定的密闭容器中分别充入
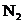 、
、
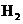 和
和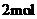
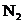 、
、
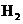 。平衡后,两容器内放出的热量分别记作
。平衡后,两容器内放出的热量分别记作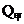 和
和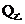 ,
,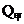 和
和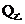 的关系是
的关系是
。
A.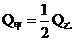 B.
B.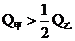 c.
c.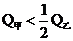 D.无法确定
D.无法确定
得分
评卷人
24.(10分)
(1)肼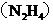 又称联氨,是一种可燃性液体,可用作火箭燃料。已知在
又称联氨,是一种可燃性液体,可用作火箭燃料。已知在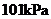 ,
,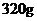
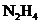 在氧气中完全燃烧生成氮气,放出热量
在氧气中完全燃烧生成氮气,放出热量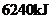 (25℃时),
(25℃时),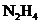 完全燃烧反应的热化学方程式是
。
完全燃烧反应的热化学方程式是
。
 (2)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的
(2)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的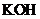 溶液。肼一空气燃料电池放电时,正极的电极反应式是
;负极的电极反应式是
。
溶液。肼一空气燃料电池放电时,正极的电极反应式是
;负极的电极反应式是
。
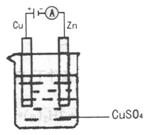
(3)如图是一个电化学过程示意图。
假设使用肼一空气燃料电池作为本过程的电源,铜片质量
变化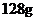 ,则肼一空气燃料电池理论上消耗标准状况下的
,则肼一空气燃料电池理论上消耗标准状况下的
空气
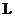 (假设空气中氧气的体积含量为20%)。
(假设空气中氧气的体积含量为20%)。
(4)传统制备肼的方法是以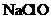 氧化
氧化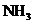 制得肼的稀溶液,该反应的离子方程式是
制得肼的稀溶液,该反应的离子方程式是
。
得分
评卷人
25.(14分)
现有A、B、C、D、E、F六种原子序数依次增大的前四周期主族元素,且分属四个周期。A、E同主族;B、C、D为同周期相邻的三种元素;B元素形成的化合物种数是所有元素中最多的;D、E简单离子具有相同的电子层结构;F与B可形成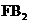 型离子化合物。请填写下列空白:
型离子化合物。请填写下列空白:
(1)D与E按原子个数比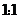 形成的化合物的电子式为
。
形成的化合物的电子式为
。
(2)B可形成多种同素异形体,其中一种同素异形体熔、沸点很高,硬度大,该同素异形体的晶体类型为 ,含有 原子的该晶体中含有的共价键的数目为
。
原子的该晶体中含有的共价键的数目为
。
(3)由A、B、D、F四种元素组成的化合物与过量的E的最高价氧化物对应水化物反应的离子方程式为 。
(4)C与E形成的―种化合物中,E元素的质量分数为35.4%,该化合物的摩尔质量不超过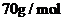 ,则该化合物的化学式为
,其中可能含有的化学键类型为
。已知该化合物在水中可以发生水解,其水解的离子方程式为
。
,则该化合物的化学式为
,其中可能含有的化学键类型为
。已知该化合物在水中可以发生水解,其水解的离子方程式为
。
得分
评卷人
四、(本题包括2小题,共24分)
26.(10分)
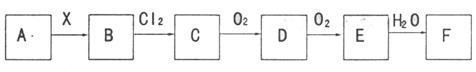
下图中,A为气体非金属单质,N、P是金属单质;N可以在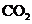 中燃烧,P是日常生活中最常见的金属,D是空气中含量最多的气体;B、E、Z为无色氢化物。其中B、E为有刺激性气味的气体,Z为液体;C是由三种短周期非金属元素组成的离子化合物,F、
中燃烧,P是日常生活中最常见的金属,D是空气中含量最多的气体;B、E、Z为无色氢化物。其中B、E为有刺激性气味的气体,Z为液体;C是由三种短周期非金属元素组成的离子化合物,F、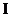 、
、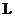 为白色沉淀,其中F不溶于稀硝酸;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
为白色沉淀,其中F不溶于稀硝酸;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
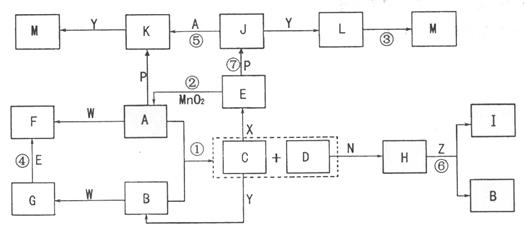 |
请按要求回答:(1)写出D的结构式 ,F的化学式 ;
(2)反应③的化学方程式为 ;
(3)反应②的离子方程式为 ;
(4)由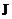 制取
制取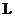 时反应的环境要求是
。
时反应的环境要求是
。
得分
评卷人
27.(14分)
有机物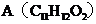 可调配果味香精。用含碳、氢、氧三种元素的有机物B和C为原料合成A。
可调配果味香精。用含碳、氢、氧三种元素的有机物B和C为原料合成A。
(1)有机物B的蒸气密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3。有机物B的分子式为 。
(2)有机物C的分子式为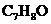 ,C能与钠反应,不与碱反应,也不能使
,C能与钠反应,不与碱反应,也不能使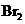 的
的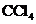 溶液褪色。C的结构简式为
。
溶液褪色。C的结构简式为
。
(3)已知两个醛分子间能发生如下反应:
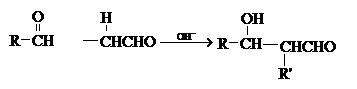
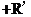
(一R、一R’表示氢原子或烃基)
用B和C为原料按如下路线合成A:
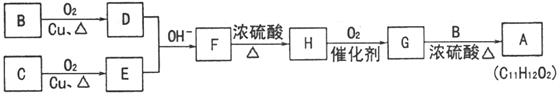 |
①上述合成过程中涉及的反应类型有: 。(填写序号)
a.取代反应 b.加成反应 c.消去反应 d.氧化反应 e.还原反应
②B转化成D的化学方程式为: 。
③G和B反应生成A的化学方程式为 。
(4)F的同分异构体有多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式: 。
得分
评卷人
28.(12分)
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含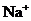 、
、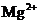 、
、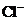 、
、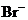 等)中模拟工业生产来提取镁,主要过程如下:
等)中模拟工业生产来提取镁,主要过程如下:
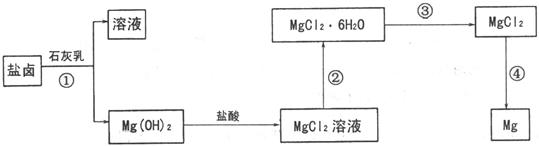 |
回答下列问题:
(1)工业上从盐卤中获取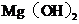 用石灰乳而不用
用石灰乳而不用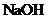 溶液的主要原因是
溶液的主要原因是
。
(2)从过程①得到的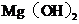 沉淀中混有少量的
沉淀中混有少量的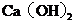 ,除去少量
,除去少量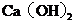 的方法是先将沉淀加入到盛有
溶液的烧杯中,充分搅拌后经
、 (填操
的方法是先将沉淀加入到盛有
溶液的烧杯中,充分搅拌后经
、 (填操
作方法)可得纯净的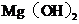 。
。
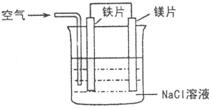
(3)下图是该兴趣小组设计进行过程③的实验装置图:
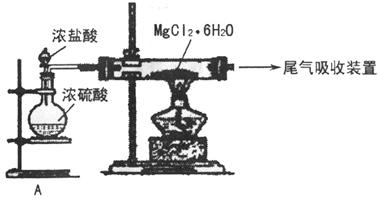
装置A由分液漏斗、 、铁架台(带铁圈)、石棉网、双孔塞和导管组成,该实验装置在过程③中的作用是 。
六、(11分)
得分
评卷人
29.(11分)
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。高.考.资.源.网
[规格]每片含琥珀酸亚铁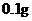
[适应症]用于缺铁性贫血症,预防及治疗用。
[用量用法]成人预防量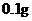 /日,成人治疗量
/日,成人治疗量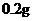 ―
―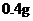 /日。
/日。
小儿用量预防量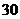 ―
―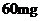 /日,治疗量
/日,治疗量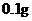 ―
―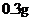 /日
/日
[贮藏]避光、密封、在干燥处保存。
(1)该药品中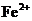 会缓慢氧化。国家规定该药物中
会缓慢氧化。国家规定该药物中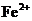 的氧化率超过
的氧化率超过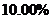 即不能再服用。
即不能再服用。
①为了检验某药店出售的“速力菲”是否氧化,实验室应选用的检验试剂为 (填试剂的名称)。
②实验室可采用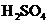 酸化的
酸化的 溶液,对“速力菲”中的
溶液,对“速力菲”中的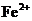 进行滴定(假设药品中其他成份不与
进行滴定(假设药品中其他成份不与 反应)。请配平下列离子方程式:
反应)。请配平下列离子方程式:
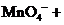
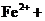
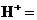
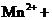
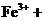
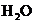
③称量上述含铁元素质量分数为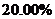 的“速力菲”
的“速力菲” 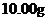 ,将其全部溶于稀
,将其全部溶于稀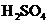 中,配制成
中,配制成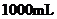 溶液,取出
溶液,取出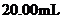 ,用
,用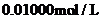 的
的 溶液滴定,用去
溶液滴定,用去 溶液
溶液 ,该药品可以服用吗? (填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程):
,该药品可以服用吗? (填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程):
(2)已知琥珀酸为二元有机酸,含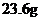 琥珀酸的溶液与
琥珀酸的溶液与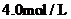
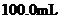 的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式)
的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式)
。
太原市2009年高三基础知识测试
第Ⅰ卷(选择题 共71分)
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
C
B
A
D
B
C
B
B
D
C
A
C
A
C
C
D
D
二、选择题(本题共5小题,每小题4分,共20分。每小题只有一个选项符合题意)
题号
18
19
20
21
22
答案
C
C
B
A
D
第Ⅱ卷 (非选择题 共79分)
三、(本题包括3小题,共32分)
23.(8分,每空2分)
(1)③
(2)增大 减小
(3)C
24.(10分,每空2分)
(1)  ;
;
(2) 

(3)112
(4)
25.(14分,每空2分)
(1)
(2)原子晶体 或
或
(3) 
(4)  离子键和共价键
离子键和共价键


四、(本题包括2小题,共24分)
26.(10分,每空2分)
(1) 

(2) 
(3) 
(4)无氧
27.(14分,每空2分)
(1) (2分)
(2分)
 (2)
(2分)
(2)
(2分)
(3)①


 (2分)
(2分)
 ②
② (2分)
(2分)
③
 |

 (2分)
(2分)
④ (2分) (2分)
五、(12分)
28.(12分,化学方程式2分,每空2分)
(1)石灰乳原料丰富,成本低
(2)  (或氯化镁) 过滤 洗涤
(或氯化镁) 过滤 洗涤
(3)圆底烧瓶 制备干燥的 气体,抑制氯化镁水解
气体,抑制氯化镁水解
六、(11分)
29.(1)①硫氰化钾溶液(2分)②1,5,8,1,5,4(2分) ③不可以(1分)


 ,所以不可以服用。(4分)
,所以不可以服用。(4分)
(2)  (2分)
(2分)