网址:http://m.1010jiajiao.com/timu_id_500499[举报]
第Ⅰ卷(选择题 共71分)
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
C
B
A
D
B
C
B
B
D
C
A
C
A
C
C
D
D
二、选择题(本题共5小题,每小题4分,共20分。每小题只有一个选项符合题意)
题号
18
19
20
21
22
答案
C
C
B
A
D
第Ⅱ卷 (非选择题 共79分)
三、(本题包括3小题,共32分)
23.(8分,每空2分)
(1)③
(2)增大 减小
(3)C
24.(10分,每空2分)
(1)  ;
;
(2) 

(3)112
(4)
25.(14分,每空2分)
(1)
(2)原子晶体 或
或
(3) 
(4)  离子键和共价键
离子键和共价键


四、(本题包括2小题,共24分)
26.(10分,每空2分)
(1) 

(2) 
(3) 
(4)无氧
27.(14分,每空2分)
(1) (2分)
(2分)
 (2)
(2分)
(2)
(2分)
(3)①


 (2分)
(2分)
 ②
② (2分)
(2分)
③
 |

 (2分)
(2分)
④ (2分) (2分)
五、(12分)
28.(12分,化学方程式2分,每空2分)
(1)石灰乳原料丰富,成本低
(2)  (或氯化镁) 过滤 洗涤
(或氯化镁) 过滤 洗涤
(3)圆底烧瓶 制备干燥的 气体,抑制氯化镁水解
气体,抑制氯化镁水解
六、(11分)
29.(1)①硫氰化钾溶液(2分)②1,5,8,1,5,4(2分) ③不可以(1分)


 ,所以不可以服用。(4分)
,所以不可以服用。(4分)
(2)  (2分)
(2分)
⑵已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气 ⑶若2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。| 容器 | SO2(mol) | O2(mol) | SO3(mol) | 热量(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 0 | 0 | 1 | Q3 |
D.2Q1 = 2Q2 < Q3 < 197kJ
⑷氨水吸收工业制硫酸尾气中的SO2的化学反应为:
下列措施中能提高燃煤烟气中去除率的有 (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
查看习题详情和答案>>
工业制硫酸时,利用催化氧化反应将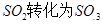 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下, 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol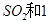 mol
mol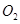 ,发生反应:
,发生反应: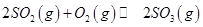 ,达平衡后改变下述条件,
,达平衡后改变下述条件,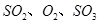 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol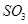
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1mol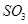
D.移动活塞压缩气体
E.升高温度
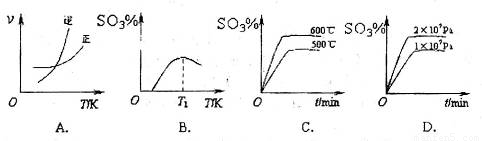
(3)下列关于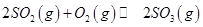 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境。于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸。
①阳极的电极反应为______________________________。
②若电解液为2L0.025mol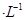 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价____________________________(写出一点即可)。
查看习题详情和答案>>
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤。
(1)某温度下,SO2(g)+![]() O2(g)
O2(g)![]() SO3(g)△H=-98 kJ·mol-1。开始时在
SO3(g)△H=-98 kJ·mol-1。开始时在
100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
 (3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2 的电极的电极反应式: 。检验其中产物有SO42-的具体操作为 。
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2 的电极的电极反应式: 。检验其中产物有SO42-的具体操作为 。
(4)常温时,BaSO4的Ksp==1.08x10-10.现将等体积的BaCl2溶液与2.0x10-3mol/l的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为______________。
(5)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,正确的是 。
2SO3(g)反应的图像中,正确的是 。

(6)SO2有氧化性又有还原性,还有漂白性。将SO2气体通入酸性KMnO4中,酸性KMnO4褪色,其中SO2体现出的性质是 。
查看习题详情和答案>>(1)已知每生成1 mol 气态SO3放出98.3kJ的热量,该反应的热化学方程式是:__________________。
(2)实际生产中,SO2的催化氧化采用400°C-500°C和常压,结合下面数据回答问题:压强及温度对SO2的转化率如下表(原料气各成分体积分数为SO2 7%,O2 11%,N2 82%)

②在400°C时,当平衡状态由0.5 MPa变到1 MPa时,平衡常数K(0.5MPa)_______K(1MPa)(填>、<、=)。
③工业生产中,SO2的催化氧化采用常压,而不是高压,其主要原因是___________,____________。
④下列变化不能提高SO2转化率的是________。
a.增大压强 b.使用催化剂 c.升高温度 d.增加O2的浓度
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于
(2)利用二氧化碳制造全降解塑料,可以缓解温室效应.已知过氧键(-O-O-)不稳定,请写出环氧乙烷与CO2通过加聚制造全降解塑料的化学方程式:


(3)CCTV《科技博览》报道:2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳(CO2)n.下列相关说法合理的是
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同分异构体
C.聚二氧化碳塑料与干冰都是纯净物
D.聚二氧化碳塑料的使用会产生白色污染
(4)最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:

①分解池中反应的化学方程式为
| ||
| ||
②在合成塔中,若有4.4kgCO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程
| ||
| 高温高压 |
| ||
| 高温高压 |
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,为了提高测量的精确度,小李应该选用的试剂为
A.Ca(OH)2 B.Ba(OH)2 C.BaCl2 D. BaCl2和NaOH.