网址:http://m.1010jiajiao.com/timu_id_500471[举报]
第Ⅰ卷(选择题 共71分)
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
C
B
A
D
B
C
B
B
D
C
A
C
A
C
C
D
D
二、选择题(本题共5小题,每小题4分,共20分。每小题只有一个选项符合题意)
题号
18
19
20
21
22
答案
C
C
B
A
D
第Ⅱ卷 (非选择题 共79分)
三、(本题包括3小题,共32分)
23.(8分,每空2分)
(1)③
(2)增大 减小
(3)C
24.(10分,每空2分)
(1)  ;
;
(2) 

(3)112
(4)
25.(14分,每空2分)
(1)
(2)原子晶体 或
或
(3) 
(4)  离子键和共价键
离子键和共价键


四、(本题包括2小题,共24分)
26.(10分,每空2分)
(1) 

(2) 
(3) 
(4)无氧
27.(14分,每空2分)
(1) (2分)
(2分)
 (2)
(2分)
(2)
(2分)
(3)①


 (2分)
(2分)
 ②
② (2分)
(2分)
③
 |

 (2分)
(2分)
④ (2分) (2分)
五、(12分)
28.(12分,化学方程式2分,每空2分)
(1)石灰乳原料丰富,成本低
(2)  (或氯化镁) 过滤 洗涤
(或氯化镁) 过滤 洗涤
(3)圆底烧瓶 制备干燥的 气体,抑制氯化镁水解
气体,抑制氯化镁水解
六、(11分)
29.(1)①硫氰化钾溶液(2分)②1,5,8,1,5,4(2分) ③不可以(1分)


 ,所以不可以服用。(4分)
,所以不可以服用。(4分)
(2)  (2分)
(2分)
(14分)CO2可转化成有机物实现碳循环。
(1)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。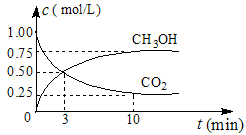
①从0 min到10 min,v(H2)= mol·(L·min)-1。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.将H2O(g)从体系中分离 B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1 mol CO2和3 mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实。
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在一定压强下,测得反应的实验数据如下表。
分析表中数据回答下列问题:
①反应的温度升高,K值 (填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”或“不变”)。
(3)800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
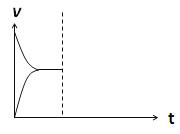
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)  CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
(14分)CO2可转化成有机物实现碳循环。
(1)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1, 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1, 测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从0 min到10 min,v(H2)= mol·(L·min)-1。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.将H2O(g)从体系中分离 B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1 mol CO2和3 mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实。
2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在一定压强下,测得反应的实验数据如下表。

分析表中数据回答下列问题:
①反应的温度升高,K值 (填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”或“不变”)。
(3)800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)
 CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
查看习题详情和答案>>
氮的氧化物(用NOx表示)是大气污染物,必须加以处理.
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体.反应化学方程式可表示为:______.
(2)步骤一
工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质.某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程.提供的装置:
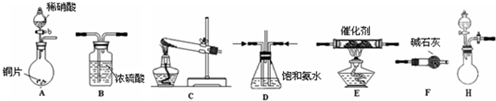
①所提供的装置中能快速、简便制取NH3的装置是:______(填仪器序号).
②若采用C装置制取氨气(控制实验条件相同),情况如下表:
| 试剂组合序号 | 固体试剂(g) | NH3体积(mL) | |
| a | 12.0g Ca(OH)2 (过量) | 10.8g NH4Cl | 2688 |
| b | 10.8g (NH4)2SO4 | 2728 | |
| c | 12.0g NaOH (过量) | 10.8g NH4Cl | 3136 |
| d | 10.8g (NH4)2SO4 | 3118 | |
| e | 12.0g CaO (过量) | 10.8g NH4Cl | 3506 |
| f | 10.8g (NH4)2SO4 | 3584 | |
步骤二.
模拟尾气的处理选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
①A中反应的离子方程式:______.
②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是:______.
③D装置中的液体可换成______(填序号).
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是:______. 查看习题详情和答案>>
CO2可转化成有机物实现碳循环。
(1)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1, 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1, 测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从0 min到10 min,v(H2)= mol·(L·min)-1。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.将H2O(g)从体系中分离 B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1 mol CO2和3 mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实。
2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在一定压强下,测得反应的实验数据如下表。
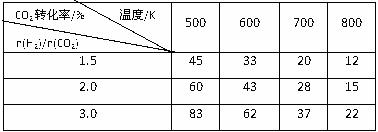
分析表中数据回答下列问题:
①反应的温度升高,K值 (填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”或“不变”)。
(3)800℃时,C(s)+CO2(g)![]() 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g) ![]() CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体.反应化学方程式可表示为: .
(2)步骤一
工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质.某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程.提供的装置:
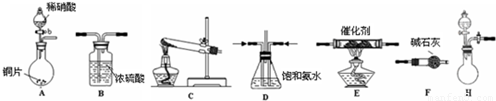
①所提供的装置中能快速、简便制取NH3的装置是: (填仪器序号).
②若采用C装置制取氨气(控制实验条件相同),情况如下表:
| 试剂组合序号 | 固体试剂(g) | NH3体积(mL) | |
| a | 12.0g Ca(OH)2 (过量) | 10.8g NH4Cl | 2688 |
| b | 10.8g (NH4)2SO4 | 2728 | |
| c | 12.0g NaOH (过量) | 10.8g NH4Cl | 3136 |
| d | 10.8g (NH4)2SO4 | 3118 | |
| e | 12.0g CaO (过量) | 10.8g NH4Cl | 3506 |
| f | 10.8g (NH4)2SO4 | 3584 | |
步骤二.
模拟尾气的处理选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
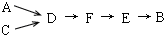
①A中反应的离子方程式: .
②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是: .
③D装置中的液体可换成 (填序号).
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是: . 查看习题详情和答案>>