网址:http://m.1010jiajiao.com/timu_id_500425[举报]
第Ⅰ卷(选择题 共71分)
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
C
B
A
D
B
C
B
B
D
C
A
C
A
C
C
D
D
二、选择题(本题共5小题,每小题4分,共20分。每小题只有一个选项符合题意)
题号
18
19
20
21
22
答案
C
C
B
A
D
第Ⅱ卷 (非选择题 共79分)
三、(本题包括3小题,共32分)
23.(8分,每空2分)
(1)③
(2)增大 减小
(3)C
24.(10分,每空2分)
(1)  ;
;
(2) 

(3)112
(4)
25.(14分,每空2分)
(1)
(2)原子晶体 或
或
(3) 
(4)  离子键和共价键
离子键和共价键


四、(本题包括2小题,共24分)
26.(10分,每空2分)
(1) 

(2) 
(3) 
(4)无氧
27.(14分,每空2分)
(1) (2分)
(2分)
 (2)
(2分)
(2)
(2分)
(3)①


 (2分)
(2分)
 ②
② (2分)
(2分)
③
 |

 (2分)
(2分)
④ (2分) (2分)
五、(12分)
28.(12分,化学方程式2分,每空2分)
(1)石灰乳原料丰富,成本低
(2)  (或氯化镁) 过滤 洗涤
(或氯化镁) 过滤 洗涤
(3)圆底烧瓶 制备干燥的 气体,抑制氯化镁水解
气体,抑制氯化镁水解
六、(11分)
29.(1)①硫氰化钾溶液(2分)②1,5,8,1,5,4(2分) ③不可以(1分)


 ,所以不可以服用。(4分)
,所以不可以服用。(4分)
(2)  (2分)
(2分)
| A、ClO-是还原剂 | B、1 molFe(OH)3 得到3 mol电子 | C、反应配平后,H2O的化学计量数为4 | D、用高铁酸钾处理水时,用到了其强氧化性,且其还原产物能水解生成具有强吸附能力的胶体 |
|
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理是Fe(OH)3+ClO-+OH-=FeO42-+Cl-+H2O(未配平).下列叙述正确的是 | |
| [ ] | |
A. |
ClO-是还原剂 |
B. |
1 mol Fe(OH)3得到3 mol电子 |
C. |
反应配平后,H2O的化学计量数为4 |
D. |
用高铁酸钾处理水时,用到了其强氧化性,且其还原产物能水解生成具有强吸附能力的胶体 |
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O
 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
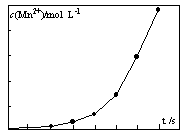
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。
 查看习题详情和答案>>
查看习题详情和答案>>
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g 左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。

查看习题详情和答案>>
熔融氧化 3MnO2+KClO3+6KOH
 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O
 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。