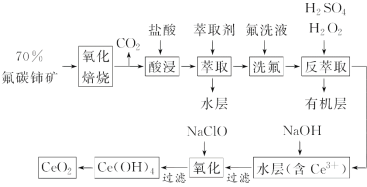
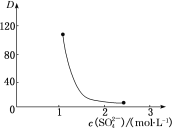
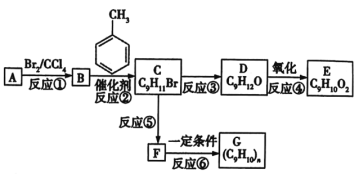
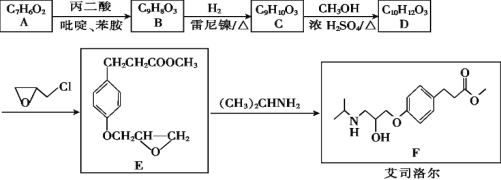
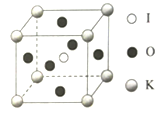
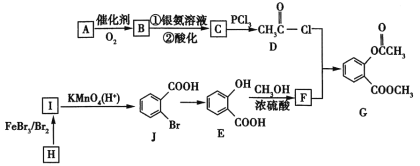
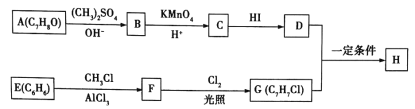
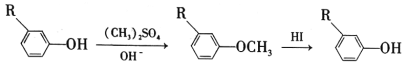
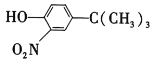
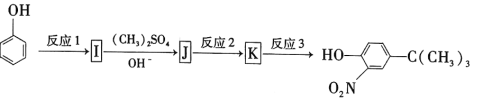
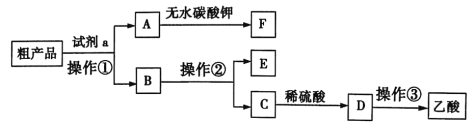
0 203403 203411 203417 203421 203427 203429 203433 203439 203441 203447 203453 203457 203459 203463 203469 203471 203477 203481 203483 203487 203489 203493 203495 203497 203498 203499 203501 203502 203503 203505 203507 203511 203513 203517 203519 203523 203529 203531 203537 203541 203543 203547 203553 203559 203561 203567 203571 203573 203579 203583 203589 203597 203614