题目内容
【题目】稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位,但近年来对其进行了掠夺性开采。二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如图:
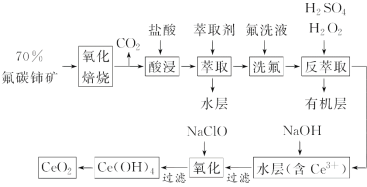
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是__。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:__。为避免产生上述污染,请提出一种解决方案:__。
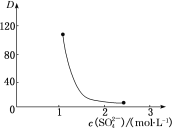
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=
Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=![]() )。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:__(用平衡移动原理解释)。
)。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:__(用平衡移动原理解释)。
(4)若缺少“洗氟”,则所得产品的质量将__(填“偏大”“偏小”或“不变”)。
(5)“反萃取”中,H2O2作__(填“催化剂”“氧化剂”或“还原剂”)。
(6)“氧化”步骤的化学方程式为__。
(7)取上述流程中得到的CeO2产品0.4000g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为__。滴定过程中可能造成实验结果偏低的是__(填字母)。
A.使用久置的FeSO4标准溶液
B.滴定终点时仰视读数
C.锥形瓶中溶液变色后立刻停止滴定,进行读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
【答案】将+3价Ce氧化为+4价Ce 2CeO2+2Cl-+8H+=2Ce3++Cl2↑+4H2O 改用硫酸酸浸 随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,c(Ce4+)减小,萃取平衡向生成Ce4+的方向移动,D迅速减小 偏小 还原剂 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl 86.00% CD
【解析】
氟碳铈矿(主要含CeFCO3),“氧化焙烧”的目的是将+3价铈氧化成+4价,Ce4+能与F-结合成[CeFx](4-x)+,以便后续的提取,加稀硫酸,与SO42-结合成[CeSO4]2+,加萃取剂,氟洗液,硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能,“反萃取”加H2O2,又将Ce4+还原为Ce3+,发生反应2Ce4++H2O2=2Ce3++O2↑+2H+,加入碱后Ce3+转化为沉淀,加入次氯酸钠将Ce从+3氧化为+4,加热分解得到产品,据此分析解答。
(1)CeFCO3中Ce显+3价,“氧化焙烧”中“氧化”的目的是将+3价铈氧化成+4价,故答案为:将+3价铈氧化成+4价;
(2)“酸浸”中会产生大量黄绿色气体为氯气,CeO2与盐酸发生氧化还原反应生成Ce3+和氯气,反应的离子方程式为2Cl-+8H++2CeO2=2Ce3++4H2O+Cl2↑,可以用硫酸代替盐酸,防止产生Cl2污染,故答案为:2Cl-+8H++2CeO2=2Ce3++4H2O+Cl2↑;改用硫酸酸浸;
(3)根据平衡:Ce4++n(HA)2Ce(H2n-4A2n)+4H+,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小,故答案为:随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,萃取平衡向生成Ce4+的方向移动,D迅速减小;
(4)若缺少“洗氟”,则会造成部分含铈物质损失,所得产品的质量将减少,故答案为:偏小;
(5)由流程图可知,经过反萃取后,Ce4+转化为Ce3+,“反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,反应的离子方程式为2Ce4++H2O2=2Ce3++O2↑+2H+,H2O2在该反应中作还原剂,故答案为:还原剂;
(6)“氧化”步骤中用次氯酸钠将Ce3+氧化成Ce4+,反应物为NaClO、Ce(OH)3,生成物为Ce(OH)4、NaCl,反应的离子方程式为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl,故答案为:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;
(7)FeSO4的物质的量为0.1000molL-1×0.02L=0.002mol,根据电子得失守恒可得关系式CeO2~FeSO4,所以CeO2的质量为0.002mol×172g/mol=0.3440g,产品中CeO2的质量分数为![]() ×100%=86.00%;A.使用久置的FeSO4溶液滴定,硫酸亚铁被氧化,滴定过程中消耗溶液体积增大,测定结果偏高,故A错误;B.滴定终点时仰视读数,取标准溶液体积增大,测定结果偏高,故B错误;C.锥形瓶中溶液变色后立刻停止滴定,进行读数,消耗标准溶液体积减少,测定结果偏低,故C正确;D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,读取标准溶液体积偏小,测定结果偏低,故D正确;故答案为:86.00%;CD。
×100%=86.00%;A.使用久置的FeSO4溶液滴定,硫酸亚铁被氧化,滴定过程中消耗溶液体积增大,测定结果偏高,故A错误;B.滴定终点时仰视读数,取标准溶液体积增大,测定结果偏高,故B错误;C.锥形瓶中溶液变色后立刻停止滴定,进行读数,消耗标准溶液体积减少,测定结果偏低,故C正确;D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,读取标准溶液体积偏小,测定结果偏低,故D正确;故答案为:86.00%;CD。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案