题目内容
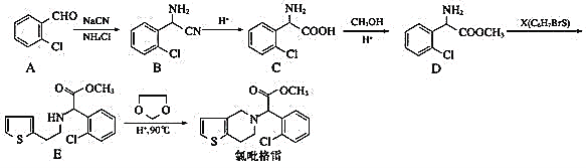
【题目】实验室制备的乙酸乙酯中含有乙酸、乙醇等杂质,如图所示是提纯乙酸乙酯的操作流程,下列有关叙述正确的是( )
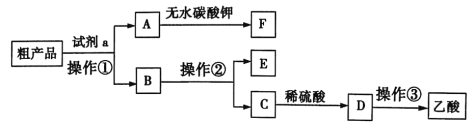
A.试剂a为NaOH溶液B.操作①为萃取
C.操作②和③均为蒸馏D.无水碳酸钾的主要作用是除去乙酸乙酯中的乙酸
【答案】C
【解析】
由图示信息可推知A、B、C、D、E、F分别为乙酸乙酯(含少量水)、乙醇和乙酸钠溶液、乙酸钠溶液、乙酸溶液、乙醇、乙酸乙酯;
A.试剂a为饱和碳酸钠溶液,在NaOH溶液中乙酸乙酯会发生水解,故A错误;
B.操作①为分液,故B错误;
C.第一次蒸馏分离出乙醇,第二次蒸馏分离出乙酸,故C正确;
D.在加入试剂a后乙酸已转化为乙酸钠,故K2CO3的主要作用是除去乙酸乙酯中的水,故D错误;
故答案选C。

练习册系列答案
相关题目