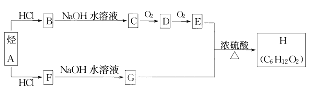
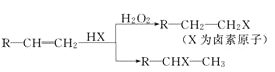
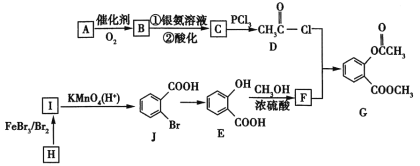
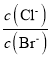题目内容
【题目】将Na2O2和Na2O的混合物mg加入到过量的300g的水中完全反应后,产生标准状况下的气体224mL,在反应后的溶液中加入0. 5mol/L H2SO4溶液100mL,恰好中和至溶液呈中性,溶液的总体积为400mL,下列计算结果错误的是( )
A.m=3.42g
B.n( Na2O2) =0. 02mol
C.n(Na2O) : n(Na2O2) =3 :2
D.最后溶液中Na2SO4的浓度为0. 25mol/L
【答案】D
【解析】
A.Na2O2和Na2O的混合物与水反应方程式为:Na2O+H2O=2NaOH、2Na2O2+2H2O=4NaOH+O2↑,产生的气体为氧气,其物质的量为![]() =0.01mol,所以混合物中n(Na2O2)=0.02mol;加入硫酸溶液恰好中和至溶液呈中性时溶液中的溶质为Na2SO4,则有n(Na+)=2n(SO42-)=0.5mol/L×0.1L×2=0.1mol,根据元素守恒可知原混合物中n(Na2O)=
=0.01mol,所以混合物中n(Na2O2)=0.02mol;加入硫酸溶液恰好中和至溶液呈中性时溶液中的溶质为Na2SO4,则有n(Na+)=2n(SO42-)=0.5mol/L×0.1L×2=0.1mol,根据元素守恒可知原混合物中n(Na2O)=![]() =0.03mol;则混合物的质量m=0.03mol×62g/mol+0.02mol×78g/mol=3.42g,故A正确;
=0.03mol;则混合物的质量m=0.03mol×62g/mol+0.02mol×78g/mol=3.42g,故A正确;
B.根据A可知n(Na2O2)=0.02mol,故B正确;
C.n(Na2O) : n(Na2O2)=0.03mol:0.02mol=3:2,故C正确;
D.最后溶液中n(Na2SO4)=n(SO42-)=0.5mol/L×0.1L=0.05mol,所以浓度为![]() ,故D错误;
,故D错误;
故答案为D。

 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】Ⅰ.现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
现有下列药品:(A)NaOH固体 (B)标准NaOH溶液(C)未知浓度盐酸 (D)蒸馏水(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是_________________________(填编号)。
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__________。
(3)做酸碱中和滴定时,还缺乏的试剂是____________________。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的______(填编号)。甲.酸式滴定管 乙.碱式滴定管 丙.锥形瓶
(5)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是______________。
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D.滴定前有气泡,滴定后气泡消失。
II. 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH2______0,ΔS______0 (填“>”、“=”或“<”=)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________。
(2)已知在常温常压下,某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
②H2O(g)=H2O(l) ΔH =-44.0 kJ·mol-1
①写出表示甲醇燃烧热的热化学方程式____________________。
②写出上图电池装置中负极反应式:________________________________。