题目内容
【题目】钾和碘的相关化合物在化工医药材料等领域有着广泛的应用。回答下列问题:
(1)基态K原子中,核外电子的空间运动状态共____种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K____(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为_____,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为_________
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图所示。
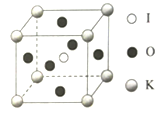
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为_______nm,与K紧邻的O的个数为______。阿伏加德罗常数的值为6.02×1023,列式计算晶体的密度为_________g/cm3.(不必计算结果)
【答案】 10 球形 < < 三角锥形 sp3杂化 HIO4中I的正电性更高,导致I-O-H中O的电子向I偏移,更容易电离出H+,酸性更强 ![]() nm 或0.386 nm 12
nm 或0.386 nm 12 ![]()
【解析】(1)基态K原子的电子排布为1s22s22p63s23p64s1,所以核外电子的空间运动状态共10种,核外电子占据的最高能层为N;K原子最外层4s轨道电子云轮廓为球形;
(2)由于K原子的半径比较大而且价电子数较少,第一电离能比较:K<Cr,金属键强度比较:K<Cr。
(3)I3+的中心碘原子的价层电子对数为![]() ,所以I3+离子的价电子对构型为正四面体,但是由于孤对电子的存在,其立体构型为三角锥形型;中心原子采用sp3杂化杂化。
,所以I3+离子的价电子对构型为正四面体,但是由于孤对电子的存在,其立体构型为三角锥形型;中心原子采用sp3杂化杂化。
(4)HIO4中I的正电性更高,导致I-O-H中O的电子向I偏移,更容易电离出H+,酸性更强,所以HIO4的酸性强于HIO3,
(5)由晶胞图可知,K原子处于顶角,I原子处于体心,两者的最近距离为立方体体对角线的一半,即![]() nm;由晶胞可知,与K原子紧邻的氧原子,在三个坐标平面中各有4个,所以共12个氧原子;由晶胞图可知,每个晶胞实际拥有:K原子:1个(8个顶点),I原子1个(体心),O原子3个(6个面心),化学式为KIO3,一个晶胞的质量为:
nm;由晶胞可知,与K原子紧邻的氧原子,在三个坐标平面中各有4个,所以共12个氧原子;由晶胞图可知,每个晶胞实际拥有:K原子:1个(8个顶点),I原子1个(体心),O原子3个(6个面心),化学式为KIO3,一个晶胞的质量为:![]() g,一个晶胞的体积为(0.446×10-7)3cm3,根据
g,一个晶胞的体积为(0.446×10-7)3cm3,根据![]() ,得晶体的密度为
,得晶体的密度为![]() g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案