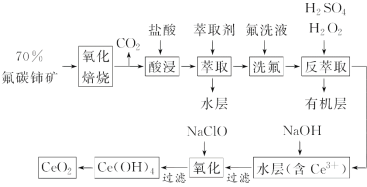
题目内容
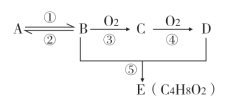
【题目】化合物H具有类似龙涎香、琥珀香的气味,香气淡而持久,被广泛用作香精的稀释剂和定香剂。合成该化合物的某种途径如图所示。
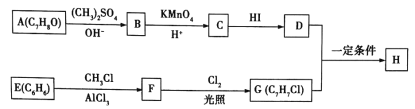
已知以下信息:
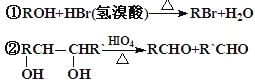
①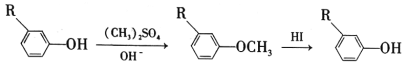 ;
;
②A的苯环上有四种化学环境不同的氢原子,且取代基的位置相邻;
③在D中滴加几滴FeCl3溶液,发生反应显出颜色;
④芳香烃F的相对分子质量介于90~100之间,0.1molF充分燃烧可生成7.2g水;
⑤R1COOH+RCH2C1![]() R1COOCH2R+HCl。
R1COOCH2R+HCl。
回答下列问题:
(1)A的化学名称是___________,由C生成D的反应的化学方程式为_______________。
(2)由F生成G的反应的化学方程式为____________________,反应类型为________________。
(3)H的结构简式为__________________。
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体有___________(不考虑立体异构)种,其分子中有5种化学环境不同的氢原子,且氢原子个数之比为1:2:2:2:1的同分异构体的结构简式是_____________(任写一种即可)。
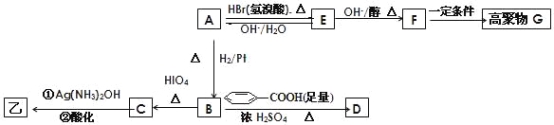
(5)苯酚经下图所示步骤可合成化合物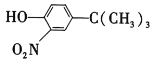 。
。
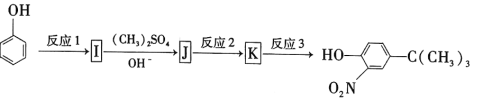
反应1所用的试剂为____________,K的结构简式为___________,反应3所用的试剂为_____________。
【答案】2-甲基苯酚(或邻甲基苯酚) ![]()
![]() 取代反应
取代反应 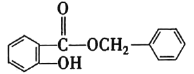 6
6 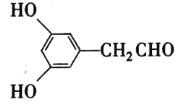 (或
(或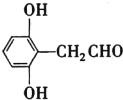 ) (CH3)3CCl和AlCl3
) (CH3)3CCl和AlCl3 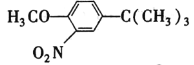 HI
HI
【解析】
根据A的分子式及已知信息②可知A结构简式为![]() ,由已知信息①可知A→B的过程发生取代反应,B是
,由已知信息①可知A→B的过程发生取代反应,B是![]() ,B→C是甲基被氧化为羧基的过程,C为
,B→C是甲基被氧化为羧基的过程,C为![]() ,C→D的过程发生的是取代反应,D是
,C→D的过程发生的是取代反应,D是![]() ;0.1mol F充分燃烧可生成7.2g水,即0.1mol F所含H为
;0.1mol F充分燃烧可生成7.2g水,即0.1mol F所含H为![]() ,结合G的分子式可知F是甲苯,E的分子式为C6H6,则E是苯,F→G的过程中F的甲基上的H被Cl取代,G为
,结合G的分子式可知F是甲苯,E的分子式为C6H6,则E是苯,F→G的过程中F的甲基上的H被Cl取代,G为![]() ;根据已知信息⑤可推出H为
;根据已知信息⑤可推出H为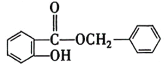 ;据此解答。
;据此解答。
(1)由分析可知, A的结构简式为![]() ,化学名称为2-甲基苯酚(或邻甲基苯酚),C→D的过程发生的是取代反应,化学方程式为
,化学名称为2-甲基苯酚(或邻甲基苯酚),C→D的过程发生的是取代反应,化学方程式为![]() ;
;
(2)由分析可知,F是甲苯,G为![]() ,F→G的过程中F的甲基上的H被Cl取代,化学方程式为
,F→G的过程中F的甲基上的H被Cl取代,化学方程式为![]() ;
;
(3)根据已知信息⑤可推出H为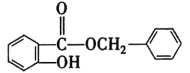 ;
;
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体,说明该同分异构体含有两个酚羟基,一个醛基,且为三取代苯,故其除酚羟基外的一个取代基是—CH2CHO,因此符合要求的同分异构体有6种;分子中有5种化学环境不同的氢原子,且氢原子个数之比为1:2:2:2:1的同分异构体的结构简式是 或
或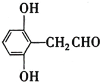 ;
;
(5)在苯环上引入—NO2,发生的是硝化反应,引入—C(CH3)3的反应原理与E→F的反应原理相同,I→J的转化过程是为了保护酚羟基,即苯酚→I的过程引入了—C(CH3)3,故反应1所用的试剂为(CH3)3CCl和AlCl3,硝酸有强氧化性,可氧化酚羟基,故在得到酚羟基之前应先进行硝化反应,故反应2所用的试剂是浓硝酸和浓硫酸,并加热生成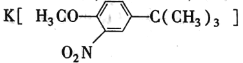 ,反应3所用的试剂是HI。
,反应3所用的试剂是HI。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生如下反应:2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.NO和O2的物质的量之比保持不变
D.每消耗1 molO2同时生成2 molNO
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达平衡后测得各组分浓度:
CH3OH(g),达平衡后测得各组分浓度:
物质 | CO | H2 | CH3OH |
浓度(mol/L) | 0.9 | 1.0 | 0.6 |
回答下列问题:
①混合气体的平均相对分子质量=_________________。
②平衡常数K=__________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正______v逆(填“>”、“<”或“=”)。
【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物 质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)。