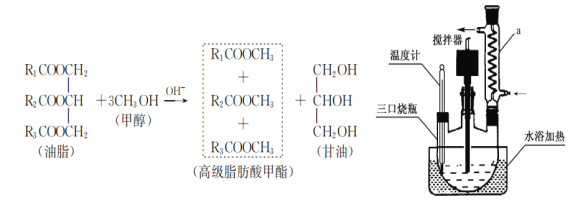
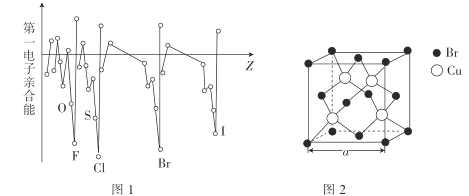
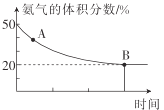
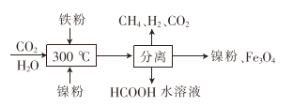
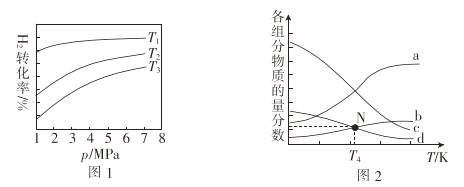
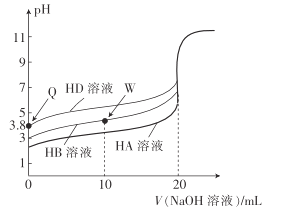
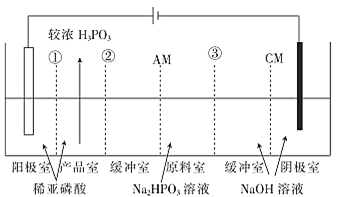
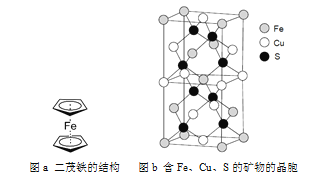
0 203279 203287 203293 203297 203303 203305 203309 203315 203317 203323 203329 203333 203335 203339 203345 203347 203353 203357 203359 203363 203365 203369 203371 203373 203374 203375 203377 203378 203379 203381 203383 203387 203389 203393 203395 203399 203405 203407 203413 203417 203419 203423 203429 203435 203437 203443 203447 203449 203455 203459 203465 203473 203614