题目内容
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋于缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化为成为有机物实现碳循环。如:
C2H4 (g) + H2O (l) = C2H5OH (l) ΔH=-44.2 kJ·mol-1
2CO2(g) + 2H2O (l) =C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol-1
2CO2(g) + 3H2O (l) = C2H5OH (l) + 3O2(g) ΔH=___________
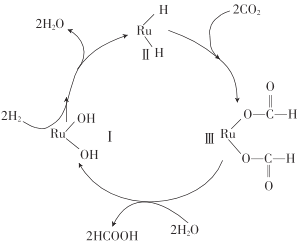
(2)CO2甲烷化反应是由法国化学家Paul Sabatier 提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程:
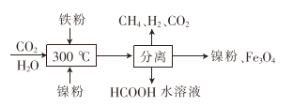
①上述过程中,产生H2反应的化学方程式为:___________________________________。
②HCOOH是CO2转化为CH4的中间体:CO2 ![]() HCOOH
HCOOH ![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g) + 4H2 (g)![]() CH4 (g) +2H2O(g)
CH4 (g) +2H2O(g)
反应II:2CO2(g) + 6H2 (g)![]() C2H4 (g) +4H2O(g)
C2H4 (g) +4H2O(g)
在1L密闭容器中冲入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为_________。T1℃时,反应I的平衡常数K=_______。

(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g) + 6H2 (g)![]() C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=
C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=![]() .
.
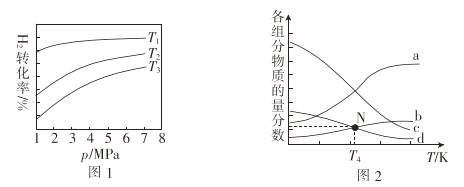
①图1中投料比相同,温度T3>T2>T1,则ΔH_____(填“>”或“<”)0.
②m=3时,该反应达到平衡状态后p(总)=20ɑ MPa ,恒压条件下各物质的物质的量分数与温度的关系如图2.则曲线b代表的物质为_______(填化学式)
【答案】+1366.8kJ·mol-1 3Fe+4H2O(g)![]() 4H2+Fe3O4 Ⅱ
4H2+Fe3O4 Ⅱ ![]()
![]() < CO2
< CO2
【解析】
(1)①C2H4 (g) + H2O (l) = C2H5OH (l) ΔH=-44.2kJ·mol-1
②2CO2(g) + 2H2O (l) =C2H4 (g) +3O2(g) ΔH=+1411.0kJ·mol-1,根据盖斯定律,①+②得:2CO2(g) + 3H2O (l) = C2H5OH (l) + 3O2(g),求焓变;
(2)①根据流程图可知反应物为:Fe、H2O,生成物为:H2、Fe3O4;
②当镍粉用量增加10倍后,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快;。
(3)1L容器,T1℃时,根据三段是:
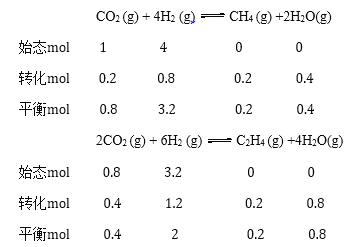
求出CO2的转化率、反应I的平衡常数K;
(4)①根据图示,温度越高,H2转化率越低,说明正反应为放热反应;
②温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,曲线a代表的物质为H2,b表示CO2,c为H2O,d为C2H5OH。
(1)①C2H4 (g) + H2O (l) = C2H5OH (l) ΔH=-44.2kJ·mol-1
②2CO2(g) + 2H2O (l) =C2H4 (g) +3O2(g) ΔH=+1411.0kJ·mol-1,根据盖斯定律,①+②得:2CO2(g) + 3H2O (l) = C2H5OH (l) + 3O2(g) ΔH=+1366.8 kJ·mol-1,故答案为:+1366.8kJ·mol-1;
(2)①根据流程图可知反应物为:Fe、H2O,生成物为:H2、Fe3O4,则化学方程式为:3Fe+4H2O(g)![]() 4H2+Fe3O4,故答案为:3Fe+4H2O(g)
4H2+Fe3O4,故答案为:3Fe+4H2O(g)![]() 4H2+Fe3O4;
4H2+Fe3O4;
②当镍粉用量增加10倍后,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快,故答案为:Ⅱ;
(3)1L容器,T1℃时,根据三段是:

CO2的转化率为![]() ;平衡时,c(CO2)=0.4mol/L,c(H2)=2mol/L ,c(CH4)=0.2mol/L ,c(H2O)=1.2mol/L ,则
;平衡时,c(CO2)=0.4mol/L,c(H2)=2mol/L ,c(CH4)=0.2mol/L ,c(H2O)=1.2mol/L ,则
T1℃时,反应I的平衡常数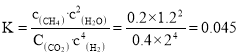 ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)①根据图示,温度越高,H2转化率越低,说明正反应为放热反应,△H<0,故答案为:<;
②温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,曲线a代表的物质为H2,b表示CO2,c为H2O,d为C2H5OH,故答案为:CO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列有关实验的操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 向Na2SO3溶液中先加入Ba(NO3)2溶液,然后再加入稀盐酸 | 生成白色沉淀,加入稀 盐酸,沉淀不溶解 |
|
C | 向盛有NH4Al(SO4)2溶液的试管中,滴加少量NaOH溶液 | 产生使湿润的红色石蕊试纸变蓝的气体 | NH4++OH- = NH3↑+H2O |
D | 测定等物质的量浓度的Na2CO3和NaClO的pH值 | Na2CO3>NaClO | 酸性:H2CO3<HClO |
A.AB.BC.CD.D
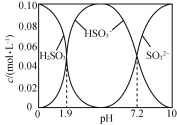
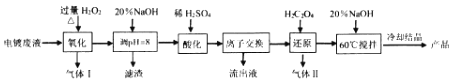
【题目】碱式硫酸铬[Cr(OH)SO4nH2O]常用于鞣制皮革,染料工业的活性黑染料、媒染剂。电镀废水中(主要含Cr2O72-、Cr3+、Fe3+、CN-、Cl-,少量Mg2+、Cu2+等离子),提取含铬废水中的铬并制成可用的碱式硫酸铬对污染治理和工业生产具有十分重要的意义。
相关金属离子[co (Mn+)= 01 molL-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Cr3+ | Fe3+ | Mg2+ | Cu2+ |
开始沉淀的pH | 4.3 | 1.9 | 9.1 | 4.7 |
沉淀完全的pH | 5.6 | 3.2 | 11.1 | 6.7 |
回答下列问题:
(1)碱式硫酸铬中Cr的化合价为_________。
(2)“氧化”时需控制反应温度在50℃~90℃,原因___________。H2O2先将CN-氧化为无害气体除去,气体I成分是________;后在碱性条件下将Cr3+ 氧化为CrO42-,滤渣中主要含________ (填相关物质的化学式)。
(3)“酸化”时CrO42-可转化为Cr2O72-,其离子方程式为________。
(4)“离子交换”过程采用钠离子交换树脂,反应原理为Mn+ +nNaR=MRn+nNa+ ,则富集到钠离子交换树脂上的金属阳离子有_________(填离子符号)。
(5)处理1L0.1molL-1Cr2O72- 的废水,理论上需要H2C2O4的物质的量为_______ mol。
(6)废水中含有的Cl-常以K2CrO4溶液为指示剂,用AgNO3标准溶液滴定测其含量,利用Ag+与CrO42-生成的砖红色沉淀指示到达滴定终点。当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10一5molL-1)时,溶液中c (Ag+)为_____molL-1 此时溶液中c(CrO42-)等于_______mo1L-1(已知Ag2CrO4、AgCl的Ksp分别约为2.0×10-12和和2.0×10 -10)。