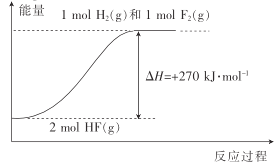
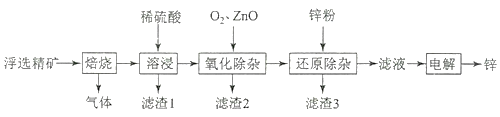
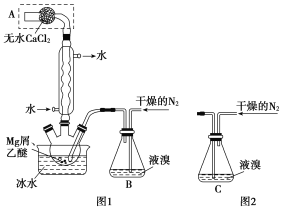
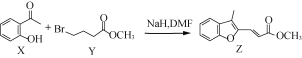题目内容
【题目】25℃时,用相同浓度的NaOH溶液,分别滴定20mL0.1mol·L-1的三种酸(HA、HB和HD)溶液体积的变化曲线如图所示。下列判断正确的是( )
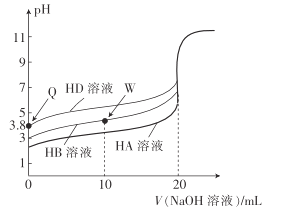
A.由Q点可知,HD的电离平衡常数Ka≈10-7.6
B.三种酸的酸性强弱:HD>HB>HA
C.滴定至W点时,溶液中存在:c(B-)>c(Na+)>c(H+)>c(OH-)
D.当三种溶液恰好完全中和后将其混合,溶液中存在:c(Na+)=c(A-)+c(B-)+c(D-)
【答案】C
【解析】
A.Q点溶液的pH=3.8,c(D-)≈c(H+)=10-3.8mol·L-1,c(HD)≈0.1mol·L-1,则HD的电离平衡常数![]() ,A错误;
,A错误;
B.根据图象可知,没有加碱时,0.1mol·L-1的三种酸(HA、HB和HD)溶液,pH大小为:HD>HB>HA,溶液pH越大酸性越弱,则三种酸的酸性强弱:HD<HB<HA,B错误;
C.W点时,加入的NaOH反应掉一半的HB,则此时溶质为等浓度的HB、NaB,HB电离出H+,B-水解产生OH-,结合图示,可知溶液的pH<7,溶液呈酸性,则c(H+)>c(OH-),,说明HB的电离程度大于B-的水解程度,则c(B-)>c(HB)。结合物料守恒c(B-)+c(HB)=2c(Na+),可知:c(B-)>c(Na+)>c(HB),溶液中离子浓度大小为:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),C正确;
D.0.1mol·L-1的三种酸的pH都大于>1,说明三种酸都是弱酸,则完全反应后生成的都是强碱弱酸盐,混合液呈碱性,则c(H+)<c(OH-),结合电荷守恒c(Na+)+c(H+)=c(A-)+c(B-)+c(D-)+c(OH-),可知:c(Na+)>c(A-)+c(B-)+c(D-),D错误。
答案选C。

【题目】下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正确的是
选项 | 分子 | 空间构型 | 杂化方式 | 孤电子对数 |
A | NH3 | 平面三角形 | sp3杂化 | N含有一对孤电子对 |
B | CCl4 | 正四面体 | sp3杂化 | C不含有孤电子对 |
C | H2O | V形 | sp2杂化 | O含有两对孤电子对 |
D | CO32- | 三角锥形 | sp3杂化 | C含有一对孤电子对 |
A. AB. BC. CD. D