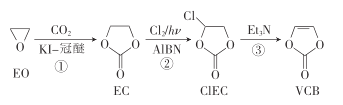
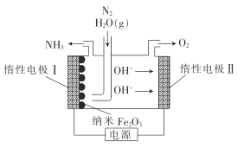
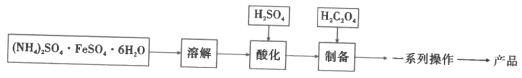
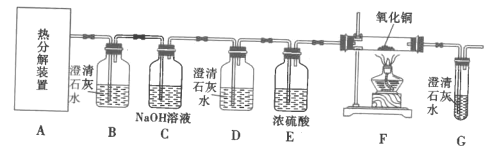
题目内容
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力
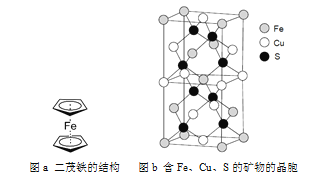
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
【答案】d Mn2+为3d5构型,d亚层半满,失去电子则需破坏此稳定结构,Fe2+为3d6,易失去1个电子成为稳定的3d5构型 > ![]() O>N>H 6 sp3
O>N>H 6 sp3 ![]() A FeCuS2(或CuFeS2)
A FeCuS2(或CuFeS2) ![]() (或
(或![]() )
)
【解析】
(1)铁元素位于元素周期表VIII族,属于d区元素;
(2)Mn2+为3d5构型,d亚层半满,失去电子则需破坏此稳定结构,Fe2+为3d6,易失去1个电子成为稳定的3d5构型,因此Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+;Mn2+与Fe3+核外电子数相同,质子数多的半径小,故半径Mn2+>Fe3+;
(3)设晶胞中铁原子半径为r,则晶胞边长为a=![]() ,则1个体心立方堆积的晶胞体积为
,则1个体心立方堆积的晶胞体积为![]() ,晶胞内共有
,晶胞内共有![]() 个原子,原子总体积为:
个原子,原子总体积为:![]() ,则其空间利用率为:
,则其空间利用率为: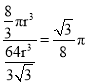 ;
;
(4)N、O处于同一周期,从左至右电负性逐渐增加,H元素在非金属元素中电负性最小,故电负性大小关系为:O>N>H;SCN-、H2O均为配体,因此[Fe(SCN)(H2O)5]2+中Fe3+的配位数为6;H2O中O的价层电子对数为![]() ,故氧原子的杂化方式为sp3;
,故氧原子的杂化方式为sp3;
(5)由![]() 结构可知,每个碳原子中还有1个电子未参与成键,5个碳原子以及一个
结构可知,每个碳原子中还有1个电子未参与成键,5个碳原子以及一个![]() 得到一个电子,共有6个电子参与形成大π键,因此
得到一个电子,共有6个电子参与形成大π键,因此![]() 中大π键表示为
中大π键表示为![]() ;由二茂铁的熔点低以及易升华特点可知二茂铁为分子化合物,因此二茂铁晶体中不存在离子键;
;由二茂铁的熔点低以及易升华特点可知二茂铁为分子化合物,因此二茂铁晶体中不存在离子键;
(6)根据均摊法可知,1个晶胞中含Cu原子数为:![]() ,Fe原子数为:
,Fe原子数为:![]() ,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞密度
,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞密度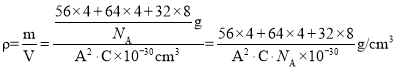 或
或![]() 。
。