题目内容
【题目】溴、铜及其化合物用途非常广泛。回答下列问题:
(1)基态Br原子核外电子排布式为[Ar]___。
(2)已知反应:Cu(BF4)2.6H2O+Cu+8CH3CN=2[Cu(CH3CN)4]BF4+6H2O。
①配合物[Cu(CH3CN)4]BF4中,与铜形成配位键的原子是___,BF4-的空间构型是___,与BF4-互为等电子体的分子有___(任写一种)。
②CH3CN分子中碳原子的杂化方式是___;1个CH3CN分子中含有___个σ键。
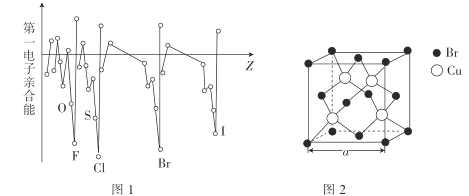
(3)电子亲合能与电离能相对应,元素的气态基态原子获得一个电子成为气态一价负离子所释放的能量称为该元素的第一电子亲合能,其大小主要取决于原子的有效核电荷、原子半径和原子的电子构型等因素。Br与F、Cl位于同一主族,第一电子亲合能(如图1所示)原比氯和溴都小,其原因是___。
(4)溴化亚铜(晶胞结构如图2所示)可用作有机合成的催化剂,密度为4.71g·cm-3。
①晶胞中Br-的配位数为___。
②晶胞参数a=___(列出表达式即可)nm。(设NA为阿伏加德罗常数的数值)
【答案】3d104s24p5 N 正四面体 CCl4(或SiF4等) sp3和sp 5 氟元素的原子半径非常小,电子云拥挤,电子间的相互排斥力很大,导致原元素的第一电子亲合能减小 4 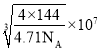
【解析】
(1)溴是35号元素,根据构造原理写出核外电子排布式;
(2)①配位化合物的形式是一方提供空轨道,另一方提供孤电子对。配体CH3CN 中N原子可提供孤电子对;判断空间构型时可利用价层电子对互斥理论。BF4-中无孤电子对,有4个σ键电子对,故呈四面体形;寻找等电子体时可利用价电子迁移法找到。
②可根据碳原子的成键方式来判断杂化类型,饱和碳原子为sp3杂化,三键碳原子为sp杂化;
(3) F原子的半径小,根据电子间排斥大,回答该题;
(4)②CuBr晶胞中含有4个Cu和4个Br,根据晶体的密度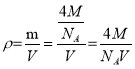 ,
,![]() ,求算a,注意单位。
,求算a,注意单位。
(1)溴是35号元素,核外电子排布式为[Ar] 3d104s24p5;
(2)①配合物的形成中,需要有金属离子提供空轨道,配体提供孤电子对,配体CH3CN中能提供孤电子对的是N,则配为原子是N。BF4-,中心原子B的价层电子对数为![]() ,还有4对共用电子对,不含孤对电子对,则空间构型为正四面体形;将BF4-中所带的负电荷迁移给B,转化为C或Si,将F替换为同族元素Cl,可找到等电子体CCl4或SiF4;
,还有4对共用电子对,不含孤对电子对,则空间构型为正四面体形;将BF4-中所带的负电荷迁移给B,转化为C或Si,将F替换为同族元素Cl,可找到等电子体CCl4或SiF4;
②配体CH3CN中,甲基上的碳为饱和的碳原子,杂化为sp3杂化,-CN中含有三键,碳原子是sp杂化;CH3CN中含有3个C-H,1个C-C,和1个C≡N,所有的单键均为σ键,三键中有1个σ键,则一共有4+1=5个σ键;
(3)同主族元素中F原子的半径最小,且电负性最大,吸引电离能力强,被吸引的电子距离原子核近,与F原子自身的电子的排斥较大,造成第一电子亲合能减小;
(4) 溴化亚铜晶胞中,4个Cu均为该晶胞所有,8个顶点的Br分别为8个晶胞所有,6个面心的Br分别为2个晶胞所有,则1个晶胞中含有![]() ,可知化学式为CuBr;
,可知化学式为CuBr;
①根据图示,与Cu相连的Br有4个,Cu的配位数4,根据化学式CuBr,可知Br的配位数也是4;
②晶体的密度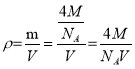 计算,CuBr的摩尔质量为144g·mol-1,
计算,CuBr的摩尔质量为144g·mol-1,![]() ,转化单位,
,转化单位,![]() ,带入数据,
,带入数据,![]() ,可得a=
,可得a=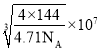 nm。
nm。

【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。


