题目内容
【题目】氮氧化物(主要为NO和NO2)是大气污染物,如何有效地消除氮氧化物的污染是目前科学家们研究的热点问题。
(1)用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。
①尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为___。用尿素溶液也可吸收氮氧化物,研究表明,当混合气体中![]() =1时,总氮还原率最高,随着,
=1时,总氮还原率最高,随着,![]() 比值增大,总氮还原率降低的主要原因是___。
比值增大,总氮还原率降低的主要原因是___。
②在一个体积为1L的恒容密闭容器中充入1molCO2和1molNH3,在恒定温度下使其发生反应2NH3(g)+CO2(g)![]() NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
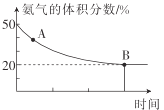
则A点时v正(CO2)___(填“>”“<”或“=”)B点时v正(CO2),原因是___。B点时,NH3的转化率为___。
③下列有关反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的说法正确的是___。
CO(NH2)2(s)+H2O(g)的说法正确的是___。
A.分离出少量的尿素,NH3的转化率将增大
B.反应达到平衡时,降低反应体系的温度,CO2的浓度减小
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高尿素的产率
(2)已知O3氧化氮氧化物的主要反应的热化学方程式如下:
2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
则反应4NO2(g)+O2(g)=2N2O5(g)△H=___(用含a、b、c的代数式表示)kJ·mol-1。
(3)氮氧化物也可用碱液吸收。若NO和NO2的混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为___;已知常温下Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(l)的平衡常数K=___。
NaNO2(aq)+H2O(l)的平衡常数K=___。
【答案】4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O NO不溶于水,难与尿素反应 > 由A点到B点,温度不变,氨气的体积分数减小,正反应速率减小 75% B
7N2+4CO2+8H2O NO不溶于水,难与尿素反应 > 由A点到B点,温度不变,氨气的体积分数减小,正反应速率减小 75% B ![]() NaNO2 5×1010
NaNO2 5×1010
【解析】
(1)①尿素[CO(NH2)2]在高温条件下与与NO2反应转化成无毒气体,即生成氮气、二氧化碳和水,根据NO不溶于水、和水不反应性质解答;
②利用三段式,求解NH3的转化率;
③根据化学平衡移动原理解答;
(2)利用盖斯定律求解△H;
(3)根据氧化还原反应规律推测生成物;化学平衡常数k定义:化学平衡常数等于生成物浓度幂积与反应物浓度幂积之比,结合Kw的关系式解答。NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,该反应中只有N元素化合价发生变化,且NO中N元素化合价为+2、NO2中N元素化合价为+4,则生成的盐中N元素化合价为+3价,即亚硝酸盐。
(1)①尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,可生成N2、CO2和水,反应的方程式为4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O;由于NO不溶于水,和水不反应,所以氮氧化物气体中NO的体积分数越大,总氮还原率降低;
7N2+4CO2+8H2O;由于NO不溶于水,和水不反应,所以氮氧化物气体中NO的体积分数越大,总氮还原率降低;
②恒温条件下,A点氨气体积分数大于B的氨气体积分数,说明A点未达到平衡,反应正向进行,B点达到平衡状态,则A到B的反应过程中,氨气的体积分数减小,正反应速率逐渐减小,有A点v正(CO2)>B点时v正(CO2);
设达到平衡状态时反应了2xmolNH3,有
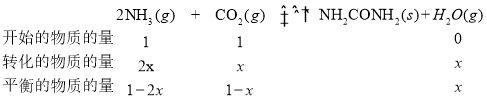
NH3的体积分数为20%,则![]() ,求得x=
,求得x=![]() mol,则NH3的转化率为
mol,则NH3的转化率为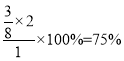 ;
;
③有关反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的说法;
CO(NH2)2(s)+H2O(g)的说法;
A.尿素是固体,浓度是个定值,分离出尿素,浓度不改变,化学反应速率不变,平衡不移动,A错误;
B.该反应是放热反应,降低温度,平衡正向移动,CO2的浓度减小,B正确;
C.根据上问的分析,设达到平衡状态时反应了2xmolNH3,NH3的转化率等于![]() ,CO2的转化率等于
,CO2的转化率等于![]() ,转化率不相等,C错误;
,转化率不相等,C错误;
D.催化剂能够对加快化学反应速率,但不能使平衡发生移动,不能提高尿素的产率,D错误。
答案选B;
(2)①2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
②NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
③6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
根据盖斯定律![]() (①+2×③-2×②)得反应4NO2(g)+O2(g)=2N2O5(g),可知△H=
(①+2×③-2×②)得反应4NO2(g)+O2(g)=2N2O5(g),可知△H=![]() (△H1+2
(△H1+2![]() (a+2c-2b);
(a+2c-2b);
(3)NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,反应中只有N元素化合价发生变化,且这两种氧化物得失电子相等,NO中N元素化合价为+2、NO2中N元素化合价为+4,则生成的盐中N元素化合价为+3价,为亚硝酸盐,化学式为NaNO2。反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(l)的平衡常数
NaNO2(aq)+H2O(l)的平衡常数![]() (由于Na+实际上没有参与反应过程,因此没有出现在表达式中。),上下同时乘以c(H+),有
(由于Na+实际上没有参与反应过程,因此没有出现在表达式中。),上下同时乘以c(H+),有![]() ,带入数据可得
,带入数据可得![]() 。
。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案