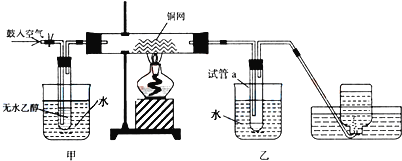
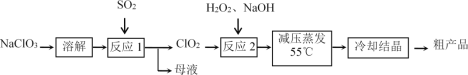
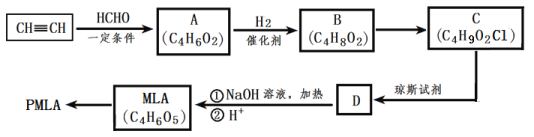
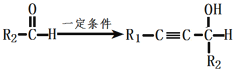
0 203088 203096 203102 203106 203112 203114 203118 203124 203126 203132 203138 203142 203144 203148 203154 203156 203162 203166 203168 203172 203174 203178 203180 203182 203183 203184 203186 203187 203188 203190 203192 203196 203198 203202 203204 203208 203214 203216 203222 203226 203228 203232 203238 203244 203246 203252 203256 203258 203264 203268 203274 203282 203614