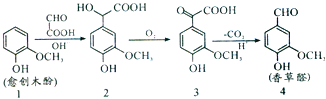
题目内容
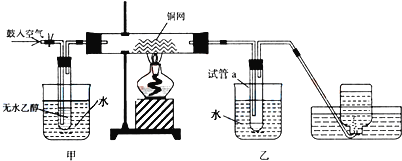
【题目】工业上亚硝酸钠可用作媒染剂、缓蚀剂等。实验室以铜、浓硝酸、氢氧化钠为原料制备亚硝酸钠的装置如图所示(部分夹持装置略)。已知:NO和NO2均能被酸性KMnO4溶液氧化为NO3-。
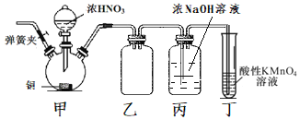
(1)连接装置后首先要进行的操作是___,然后装入药品。
(2)装置甲中反应的离子方程式为___。
(3)装置乙的作用是___。
(4)实验结束后,打开甲装置的弹簧夹,通入N2,其目的是___。
(5)装置丁的作用是___。
(6)为了测定丙中NaNO2的浓度,取丙中溶液20.00mL,用0.1000mol/L的酸性KMnO4溶液进行滴定,消耗KMnO4溶液10.00mL。请回答:
①酸性KMnO4溶液盛放在___滴定管中。
②判断滴定达终点时的依据为___。
③写出上述反应的离子方程式___,计算出NaNO2的浓度为___mol/L。
④配制酸性KMnO4溶液定容时,俯视容量瓶的刻度线,NaNO2的浓度___。(填“偏高”、“偏低”或“无影响”)
【答案】检查装置的气密性 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 安全瓶,防止倒吸 排尽装置中残留有毒气体(防止污染环境) 吸收尾气,防止污染环境 酸式 当滴入最后一滴标准液后,锥形瓶中的溶液由无色变为紫色,且半分钟内不褪 5NO2+2MnO4-+6H+=5NO3-+2Mn2++3H2O 0.125 偏低
【解析】
甲装置由Cu和浓硝酸制备NO2,乙装置为安全瓶防止NO2与氢氧化钠溶液反应而产生倒吸,丙装置由NO2和NaOH制备NaNO2,丁装置用酸性高锰酸钾吸收未反应完的NO2和生成的NO气体,据此解答。
(1)装置中有气体参与,故连接好装置之后,应检查装置气密性;
(2)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,离子反应方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(3)为防止NO2与氢氧化钠溶液反应而产生倒吸,因此装置乙的作用是安全瓶,防止倒吸;
(4)实验中产生的NO和NO2有毒,不能排放到空气中,要全部除去,打开甲装置的弹簧夹,通入N2,其目的是排尽装置中残留有毒气体(防止污染环境);
(5)装置丁的作用是吸收尾气,防止污染环境;
(6)①酸性KMnO4溶液具有氧化性,只能使用酸式滴定管盛装;
②酸性KMnO4自身可做指示剂,当滴入最后一滴标准液后,锥形瓶中的溶液由无色变为紫色,且半分钟内不褪,即为达到终点;
③亚硝酸根离子与酸性高锰酸钾发生氧化还原反应得到硝酸根离子和锰离子,离子反应为:5NO2+2MnO4-+6H+=5NO3-+2Mn2++3H2O,滴定时消耗KMnO4溶液10.00mL,高锰酸钾的物质的量=0.01L×0.1000mol/L=0.001mol,则亚硝酸钠的物质的量=![]() ×0.001mol=0.0025mol,其浓度为
×0.001mol=0.0025mol,其浓度为![]() =0.125mol/L;
=0.125mol/L;
④配制酸性KMnO4溶液定容时,俯视容量瓶的刻度线,高锰酸钾溶液的体积偏小,浓度偏大,滴定时消耗高锰酸钾的体积偏小,计算的NaNO2的浓度偏低。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
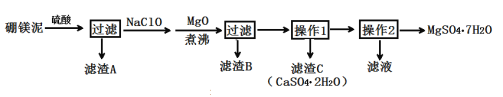
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。