题目内容
【题目】250C时,向20.0mL0.10mol/L氨水中滴入0.10mol/L盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
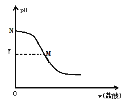
A.本实验应选用的指示剂是甲基橙
B.M点处的溶液中c(NH4+)=c(Cl)>c(H+)=c(OH)
C.N点处的溶液中pH<12
D.M点对应的盐酸体积为20.0mL
【答案】D
【解析】
A.氨水中滴入盐酸,滴定终点时生成氯化铵,显酸性,则选甲基橙作为指示剂,故A正确;
B.M点显中性,c(H+)=c(OH),电荷守恒式为c(NH4+)+c(H+)=c(Cl)+c(OH),且显性离子大于隐性离子,则存在c(NH4+)=c(Cl)>c(H+)=c(OH),故B正确;
C.N点为氨水溶液,氨水浓度为0.10molL-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol·L-1×1.32%=1.32×10-3mol·L-1,c(H+)=![]() mol·L-1=7.6×10-10mol·L-1,pH=-lgc(H+),所以该点溶液pH<12,故C正确;
mol·L-1=7.6×10-10mol·L-1,pH=-lgc(H+),所以该点溶液pH<12,故C正确;
D.若M点盐酸的体积为20.0mL,等体积等浓度恰好生成氯化铵,水解显酸性,则不可能显中性,则盐酸的体积应小于20mL时可能显中性,故D错误;
答案选D。

【题目】利用下图装置可以进行实验并能达到实验目的的是
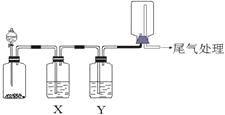
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大